题目内容
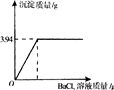 (2006?云南)实验室里有一瓶固体烧碱因吸收了空气中的二氧化碳而部分变质.为测定这瓶烧碱的纯度,称取该样品10g溶于水配成溶液,向其中逐滴加入氯化钡溶液至沉淀完全(反应方程式为Na2CO3+BaCl2═BaCO3↓+2NaCl).反应过程中生成沉淀的质量与所用氯化钡溶液质量的关系如下图所示,请计算该烧碱样品中氢氧化钠的质量分数.
(2006?云南)实验室里有一瓶固体烧碱因吸收了空气中的二氧化碳而部分变质.为测定这瓶烧碱的纯度,称取该样品10g溶于水配成溶液,向其中逐滴加入氯化钡溶液至沉淀完全(反应方程式为Na2CO3+BaCl2═BaCO3↓+2NaCl).反应过程中生成沉淀的质量与所用氯化钡溶液质量的关系如下图所示,请计算该烧碱样品中氢氧化钠的质量分数.分析:由图象可知:曲线的转折点即碳酸钠溶液和氯化钡溶液恰好完全反应,此时生成沉淀的质量是3.94g,然后根据反应方程式,用恰好反应时生成碳酸钡的质量计算出10g样品中碳酸钠的质量,氢氧化钠的质量=样品质量-碳酸钠的质量,并根据质量分数计算公式求出样品中氢氧化钠的质量.
解答:解:设样品中碳酸钠的质量是X.
Na2CO3+BaCl2═BaCO3↓+2NaCl
106 197
X 3.94g
=
X=2.12g
所以样品中氢氧化钠的质量是10g-2.12g=7.88g;
则样品中氢氧化钠的质量分数是:
×100%=78.8%.
答:该烧碱样品中氢氧化钠的质量分数是78.8%.
Na2CO3+BaCl2═BaCO3↓+2NaCl
106 197
X 3.94g
| 106 |
| X |
| 197 |
| 3.94g |
X=2.12g
所以样品中氢氧化钠的质量是10g-2.12g=7.88g;
则样品中氢氧化钠的质量分数是:
| 7.88g |
| 10g |
答:该烧碱样品中氢氧化钠的质量分数是78.8%.
点评:解此类图象题时,关键要明确图象的转折点即恰好完全反应的点,找出已知量,然后依据方程式解答.

练习册系列答案
相关题目
