题目内容
50g镁、铁、锌的混合物与足量的稀硫酸反应产生氢气3.6g,将反应后的混合物溶液蒸发、脱水后得到无水硫酸盐,其质量是 .
考点:金属的化学性质,根据化学反应方程式的计算
专题:金属与金属材料
分析:已知Mg→MgSO4; Zn→ZnSO4; Fe→FeSO4.并且可知道,在H2SO4中氢元素与硫酸根的质量比为2:96.
解答:解:因为生成氢气的质量为3.6g,设混合物中的SO4的质量为x
根据关系式SO4~H2↑,
96 2
x 3.6g
则
=
x=172.8g
所以无水硫酸盐的质量为172.8g+50g=222.8g;
故答案为:222.8g.
根据关系式SO4~H2↑,
96 2
x 3.6g
则
| 96 |
| x |
| 2 |
| 3.6g |
x=172.8g
所以无水硫酸盐的质量为172.8g+50g=222.8g;
故答案为:222.8g.
点评:运用质量守恒定律,了解物质反应前后有什么不同,从中找出规律,确定计算思路.

练习册系列答案
 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
下列生活中常见的现象,属于化学变化的是( )
| A、破冰钓鱼 | B、铜像生绿毛 |
| C、灯泡发光 | D、甘蔗榨汁 |
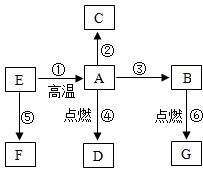 下列物质是初中化学常见的物质,A是常见的金属,②是湿法冶金的先驱,④的反应现象是火星四射,E是红棕色固体,F是黄色溶液,G是最常见的液体,这些物质之间的转化关系如图所示(部分反应物、生成物已省略):
下列物质是初中化学常见的物质,A是常见的金属,②是湿法冶金的先驱,④的反应现象是火星四射,E是红棕色固体,F是黄色溶液,G是最常见的液体,这些物质之间的转化关系如图所示(部分反应物、生成物已省略): 如图是甲、乙两种物质的溶解度曲线,请结合如图回答问题:
如图是甲、乙两种物质的溶解度曲线,请结合如图回答问题: 某人在一容器中进行了如图实验,请填空:
某人在一容器中进行了如图实验,请填空: