题目内容
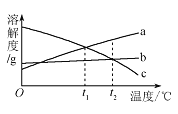
【题目】取氢氧化钠和硫酸钠的混合物20 g,加入100 g水使其完全溶解,再加入100 g硫酸铜溶液,恰好完全反应,过滤,得到210.2 g滤液(不考虑实验过程中的损失)。计算:
(1)该混合物中氢氧化钠的质量____________________。
(2)所加硫酸铜溶液中溶质的质量分数___________________。
(3)反应后所得滤液中溶质的质量分数_____________________(计算结果保留至0.1%)。
【答案】8g 16% 12.5%
【解析】
解:(1)由质量守恒定律可知,产生氢氧化铜的质量=20g+100g+100g-210.2g=9.8g;
设:产假反应氢氧化钠的质量为x,硫酸铜的质量为y,生成硫酸钠的质量为z。

![]()
x=8g
![]()
y=16g
![]()
z=14.2g
混合物中氢氧化钠的质量为8g;
(2)所加硫酸铜溶液中溶质的质量分数为![]() ;
;
(3)滤液中溶质为Na2SO4其质量为![]()
则反应后所得滤液中溶质的质量分数为![]()

【题目】电石是一种重要的化工原料。同学们借助网络资源和化学实验对电石的性质和变化进行如下的科学探究,请你也参与其中。
(查阅资料)
①电石的主要成分为碳化钙(化学式为CaC2),碳化钙与水反应生成一种白色固体和一种可燃性气体。
②将紫甘蓝汁液分别滴入下列液体中,显示的颜色如下表:
液体名称 | 白醋 | 食盐溶液 | 肥皂水 | 纯碱溶液 |
紫甘蓝汁液显示的颜色 | 红色 | 蓝紫色 | 蓝色 | 绿色 |
(作出猜想)根据碳化钙及水的组成推测:①碳化钙与水反应生成的白色固体可能是___________(写出两种物质)。
②碳化钙与水反应生成的可燃性气体可能是H2、CH4或C2H2(乙炔)。
(实验探究)同学们在老师的指导下,按如下步骤进行实验:
(1)取适量的电石加水,剧烈反应,放出大量的热,产生无色气体。
(2)收集反应生成的气体,验纯后点燃,发现气体燃烧时产生黄色火焰并伴有浓烈黑烟,因此该气体不可能是_____________。
(3)分别取反应生成的白色固体于两支试管中,进行如下的操作:
实验操作 | 实验现象 | 实验结论 |
①向一支试管中滴加足量的稀盐酸 | 固体溶解,但无气体产生 | 白色固体是________ |
②向另一支试管中加入适量的水,振荡、静置,再向上层清液中滴加_________ | 溶液变为绿色 |
(实验结论)碳化钙与水反应的化学方程式为___________。
(问题交流)
(1)存放电石的库房若发生火灾,___________(填“能”或“不能”)用水扑救。
(2)乙炔(C2H2)含碳量极高,它在空气中燃烧会冒出浓厚的黑烟(炭黑)。要使乙炔气体充分燃烧,常采用的方法是_____________。