题目内容
有NaOH和Na2CO3混合物l8.6g。为测定其中NaOH的质量,将固体溶于水,并逐渐加入稀硫酸至100g时,开始产生气体;再加入稀硫酸至100g时,不再产生气体,生成气体共4.4g(提示:Na2CO3+ H2SO4 = Na2SO4+ CO2↑+H2O)
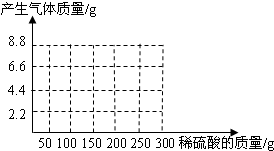
(1)在图28中画出产生气体的质量与所加稀硫酸质量的关系曲线。
(2)求混合物中NaOH的质量是多少?
(3)所用稀硫酸的溶质质量分数是多少?

【答案】
(5分)
(1)如右图(1分)

解:(2)设混合物中Na2CO3的质量为x,100g硫
酸溶液中H2SO4的质量为y。
Na2CO3+ H2SO4 = Na2SO4+H2O+ CO2↑
106 98 44
x y 4.4g
x = 10.6g (1分)
y = 9.8g (1分)
混合物中氢氧化钠的质量为18.6g-10.6g=8.0g (1分)
(3)稀硫酸的溶质质量分数为:9.8g/100g×100%=9.8% (1分)
答:略
【解析】略

练习册系列答案
相关题目
 有NaOH和Na2CO3混合物l8.6g.为测定其中NaOH的质量,将固体溶于水,并逐渐加入稀硫酸至100g时,开始产生气体;再加入稀硫酸至100g时,不再产生气体,生成气体共4.4g
有NaOH和Na2CO3混合物l8.6g.为测定其中NaOH的质量,将固体溶于水,并逐渐加入稀硫酸至100g时,开始产生气体;再加入稀硫酸至100g时,不再产生气体,生成气体共4.4g

