题目内容
碳酸钠和氢氧化钠的混合物8.5g溶于53.7g水中,向所得溶液中加入40g稀盐酸,刚好与混合物完全反应,这时生成的气体为2.2g.求:
(1)混合物中各成分的质量;
(2)反应后溶液中溶质的质量分数.
(1)混合物中各成分的质量;
(2)反应后溶液中溶质的质量分数.
设混合物中碳酸钠的质量为x,会生成氯化钠质量为y,
2HCl+Na2CO3═2NaCl+H2O+CO2↑
106 117 44
x y 2.2g
=
=
解得:x=5.3g,y=5.85g
所以氢氧化钠的质量是:8.5g-5.3g=3.2g,
(2)3.2g克氢氧化钠与盐酸反应生成氯化钠质量为z,
NaOH+HCl═NaCl+H2O
40 58.5
3.2g z
=
解得:z=4.68g
所以反应后溶液的溶质的质量为:5.85g+4.68g=10.53g,
反应后溶液中溶质的质量分数为:
×%100%=10.53%
答:(1)混合物中碳酸钠的质量为5.3g,氢氧化钠的质量为3.2g;
(2)反应后溶液中溶质的质量分数为10.53%.
2HCl+Na2CO3═2NaCl+H2O+CO2↑
106 117 44
x y 2.2g
| 106 |
| x |
| 117 |
| y |
| 44 |
| 2.2g |
解得:x=5.3g,y=5.85g
所以氢氧化钠的质量是:8.5g-5.3g=3.2g,
(2)3.2g克氢氧化钠与盐酸反应生成氯化钠质量为z,
NaOH+HCl═NaCl+H2O
40 58.5
3.2g z
| 40 |
| 3.2g |
| 58.5 |
| z |
解得:z=4.68g
所以反应后溶液的溶质的质量为:5.85g+4.68g=10.53g,
反应后溶液中溶质的质量分数为:
| 10.53g |
| 8.5g+53.7g+40g-2.2g |
答:(1)混合物中碳酸钠的质量为5.3g,氢氧化钠的质量为3.2g;
(2)反应后溶液中溶质的质量分数为10.53%.

练习册系列答案
相关题目
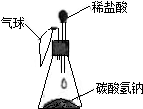
若在试剂瓶中放入某种物质,先滴加滴管l中液体后,小气球变鼓,再滴加滴管2中液体后,小气球又变瘪。下列与所描述现象相符 的一组是
的一组是
| 试剂瓶中的物质 | 滴管中的物质 | ||
| 滴管l | 滴管2 | ||
| A | 冰 | 水 | 稀硫酸 |
| B | 稀盐酸 | 碳酸氢钠溶液 | 浓硫酸 |
| C | 生石灰 | 水 | 稀盐酸 |
| D | 二氧化碳 | 氢氧化钠溶液 | 稀盐酸 |
D
9.下列各组物质只用一种试剂无法鉴别出的是
A. NH4N03、NaOH、NaCl B.NaCl溶液、HCI溶液 、NaOH溶液
C.Na2C03溶液、AgNO3溶液、NaCl溶液D. KCl溶液、KN03溶液、NaCl溶液
D
lO.下列图像分别表示四个实验过程中的某些变化,其中正确的是
| A | B | C | D |
| 向一定量铁粉中加入稀盐酸 | 向pH=2的稀盐酸中加 入pH=12的氢氧化钠溶液 | 现有盐酸和CaCl的混 合溶液,向其中逐滴加 入过量碳酸钠溶液 | 向足量且溶质质量分数 相等的稀硫酸中分别加 入等质量的金属镁和铁 |
|
|
|
|
|

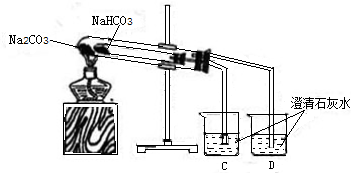
 27、利用纯碱在实验室可以制取许多物质,某研究性学习小组对纯碱展开如下探究:
27、利用纯碱在实验室可以制取许多物质,某研究性学习小组对纯碱展开如下探究: 28、利用纯碱在实验室可以制取许多物质,某研究性学习小组对纯碱展 开如下探究:
28、利用纯碱在实验室可以制取许多物质,某研究性学习小组对纯碱展 开如下探究: