题目内容
 铁、铜和铝是人类生产生活中常用的金属.
铁、铜和铝是人类生产生活中常用的金属.(1)地壳中含量最多的金属元素是
铝
铝
.(2)用铜、铝做导线,利用了它们的
导电性
导电性
性.(3)铁锅易生锈,铁生锈的条件是铁与空气中的水和
氧气
氧气
共同作用的结果,防止家中铁锅锈蚀的方法是在钢铁表面涂油(或刷漆)
在钢铁表面涂油(或刷漆)
(答一种).(4)“曾青得铁则化为铜”(西汉?刘安《淮南万毕术》)被誉为现代湿法冶金的先驱.意思是铁与天然存在的硫酸铜溶液发生反应置换生成单质铜,该反应的化学方程式为
Fe+CuSO4=Cu+FeSO4
Fe+CuSO4=Cu+FeSO4
.分析:(1)地壳中含量最高的金属是铝.
(2)金属具有导电性.
(3)钢铁生锈实际是铁与空气中的氧气和水分发生化学反应的结果.
(4)由“曾青得铁则化为铜”的知识可知,此过程是硫酸铜的溶液放入金属铁得到铜的过程.
(2)金属具有导电性.
(3)钢铁生锈实际是铁与空气中的氧气和水分发生化学反应的结果.
(4)由“曾青得铁则化为铜”的知识可知,此过程是硫酸铜的溶液放入金属铁得到铜的过程.
解答:解:(1)地壳中含量最高的金属是铝.
故答案为:铝.
(2)电路中的导线多数是用铜、铝制做的,利用的是它们的导电性.
故答案是:导电性.
(3)钢铁生锈实际是铁与空气中的氧气和水分发生化学反应.所以在钢铁表面涂油、刷漆等,能防止钢铁生锈.
故答案是:氧气,在钢铁表面涂油(或刷漆).
(4):“曾青得铁则化为铜”,其中的“曾青”就是指硫酸铜,这句话的意思就是说:硫酸铜溶液遇到金属铁时,铁与硫酸铜发生置换反应能生成金属铜,
该反应的化学方程式为Fe+CuSO4=Cu+FeSO4.
故答案是:Fe+CuSO4=Cu+FeSO4.
故答案为:铝.
(2)电路中的导线多数是用铜、铝制做的,利用的是它们的导电性.
故答案是:导电性.
(3)钢铁生锈实际是铁与空气中的氧气和水分发生化学反应.所以在钢铁表面涂油、刷漆等,能防止钢铁生锈.
故答案是:氧气,在钢铁表面涂油(或刷漆).
(4):“曾青得铁则化为铜”,其中的“曾青”就是指硫酸铜,这句话的意思就是说:硫酸铜溶液遇到金属铁时,铁与硫酸铜发生置换反应能生成金属铜,
该反应的化学方程式为Fe+CuSO4=Cu+FeSO4.
故答案是:Fe+CuSO4=Cu+FeSO4.
点评:本题是对基础知识的考查,只有同学们熟悉课本知识,就可做好此题.

练习册系列答案
相关题目
 金属是现代生活和工业生产中应用极为普遍的一类材料.
金属是现代生活和工业生产中应用极为普遍的一类材料.(1)已知在相同的条件下,金属的活动性越强,金属和酸反应产生气泡(氢气)的速度就越快.Al、Cu、Fe三种金属在稀盐酸里的反应现象如右图所示.
①右图中Y所代表的金属是
②Al、Cu、Fe三种金属的活动性由强到弱的顺序为
③铝是一种活泼金属,但常温下铝却有较强的抗腐蚀性,其原因是
(2)金属的开发和利用是人类文明和社会进步的标志.
①我国古代将炉甘石(ZnCO3)、赤铜矿(Cu2O)和木炭粉混合加热至800℃左右,即可得到与黄金外观相似的“药金”.
I.用上述方法不能制得真正的黄金(Au)是因为
II.“药金”是
②钛因常温下不与酸、碱反应等优良的性能,被誉为“未来金属”.由钒钛磁铁矿提取金属钛的主要工艺过程如下:
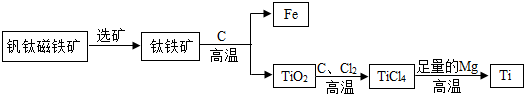
在高温下与足量Mg反应置换生成金属Ti,该反应的化学方程式为:
上述生产过程中得到的金属钛中混有少量金属杂质,可加入
(3)已知某金属粉末中除含有Al外还含有一定量的Fe和Cu,为证明Fe和Cu的存在并测定其中Al的质量分数,某化学兴趣小组的同学展开了如下的实验探究.
资料在线:Al与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(反应的化学方程式为:2Al+2H2O+2NaOH=2NaAlO2+3H2↑),Fe和Cu不与氢氧化钠溶液反应.
①请完成证明金属粉末中存在Fe和Cu的实验设计:
| 实验操作 | 实验现象 | 结论 |
| Ⅰ取少量的金属粉末于试管中,加入足量的 |
仅除去铝 | |
| Ⅱ将试管静置,弃去上层清液,加入足量的稀硫酸. | 证明含有铁 | |
| Ⅲ将试管静置,弃去上层清液,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
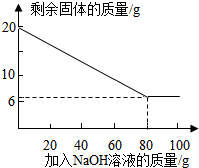 ②为探究该金属粉末中Al的质量分数,取20 g该金属粉末,把100 g氢氧化钠溶液平均分成5份依次加入,充分反应后,过滤出固体,将其洗涤、干燥、称量.实验过程中得到的部分数据与图象如下:
②为探究该金属粉末中Al的质量分数,取20 g该金属粉末,把100 g氢氧化钠溶液平均分成5份依次加入,充分反应后,过滤出固体,将其洗涤、干燥、称量.实验过程中得到的部分数据与图象如下:| 加NaOH溶液的次数 | 第一次 | 第二次 | 第三次 | … |
| 剩余固体的质量/g | 16.5 | n | 9.5 | … |
Ⅱ.该金属粉末中Al的质量分数为
Ⅲ.列式计算:所用氢氧化钠溶液的溶质质量分数为多少?
 铁、铜和铝是人类生产生活中常用的金属.
铁、铜和铝是人类生产生活中常用的金属.