题目内容
19.除去下列物质中的少量杂质(括号内为杂质),使用的方法错误的是( )| A. | CO2(CO):足量的碳、高温 | B. | N2(O2):通过足量的红磷 | ||
| C. | CaO(CaCO3):高温煅烧 | D. | NaCI(Na2CO3):过量的HCl,蒸发 |
分析 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答 解:A、CO2能与足量的碳在高温下反应生成一氧化碳,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误.
B、O2常温下通过足量的红磷不反应,不能除去杂质,不符合除杂原则,故选项所采取的方法错误.
C、CaCO3固体高温煅烧生成氧化钙和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确.
D、Na2CO3能与过量的HCl反应生成氯化钠、水和二氧化碳,盐酸具有挥发性,再蒸发除去盐酸,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确.
故选:AB.
点评 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.酸、碱、盐溶解性表是学习科学的重要工具,上表列出了“部分酸、碱、盐在20℃时的溶解性”.请利用此表完成下列任务:
(1)查Mn(OH)2的溶解性不溶(填“溶”或“不溶”)
(2)用化学方程式表示CuSO4与标准的一种物质发生反应:CuSO4+2KOH=K2SO4+Cu(OH)2↓.
| OH- | NO3- | Cl- | SO42- | |
| H+ | 溶、挥 | 溶、挥 | 溶 | |
| K+ | 溶 | 溶 | 溶 | 溶 |
| Mg2+ | 不溶 | 溶 | 溶 | 溶 |
| Mn2+ | 不溶 | 溶 | 溶 | 溶 |
(2)用化学方程式表示CuSO4与标准的一种物质发生反应:CuSO4+2KOH=K2SO4+Cu(OH)2↓.
7.下列操作或装置中只发生物理变化的是( )
| A. |  O2性质验证 | B. |  电解水 | ||
| C. |  用玻璃刀裁划玻璃 | D. |  CO2性质验证 |
14.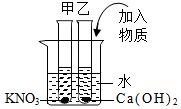 表为硝酸钾和氢氧化钙在不同温度下的溶解度.如图所示,甲、乙试管分别盛有20℃时硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体.现向烧杯内的水中加入某物质后,甲试管中固体消失,乙试管中固体增加,则加入的物质可能是( )
表为硝酸钾和氢氧化钙在不同温度下的溶解度.如图所示,甲、乙试管分别盛有20℃时硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体.现向烧杯内的水中加入某物质后,甲试管中固体消失,乙试管中固体增加,则加入的物质可能是( )
 表为硝酸钾和氢氧化钙在不同温度下的溶解度.如图所示,甲、乙试管分别盛有20℃时硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体.现向烧杯内的水中加入某物质后,甲试管中固体消失,乙试管中固体增加,则加入的物质可能是( )
表为硝酸钾和氢氧化钙在不同温度下的溶解度.如图所示,甲、乙试管分别盛有20℃时硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体.现向烧杯内的水中加入某物质后,甲试管中固体消失,乙试管中固体增加,则加入的物质可能是( )| 温度(℃) | 10 | 20 | 40 | 60 | 80 |
| 氢氧化钙的质量(温度) | 0.173 | 0.165 | 0.121 | 0.120 | 0.095 |
| 硝酸钾的质量 | 13.3 | 31.6 | 63.9 | 110 | 169 |
| A. | 硝酸铵 | B. | 氢氧化钠 | C. | 蔗糖 | D. | 氯化钠 |
11.下列关于分子、原子、离子的说法不正确的是( )
| A. | 二氧化碳、水、氨气都是由分子构成的物质 | |
| B. | 氯化钠、硫酸铜都是由离子构成的物质 | |
| C. | 铁、硫、汞等金属单质都是由原子构成的物质 | |
| D. | 氧气、硅、金刚石等非金属单质都是由分子构成的物质 |
8.下列有关微粒的说法不正确的是( )
| A. | 4℃时水分子的质量最大,所以4℃水的密度最大 | |
| B. | 钠原子失去1个电子形成钠离子,钠原子和钠离子属于同种元素 | |
| C. | 分子、原子、离子都是构成物质的微粒,构成物质的微粒在不断运动 | |
| D. | 原子中不一定含有中子,质子和中子的质量近似相等,电性不同,数目可能相等 |
9.在实验室里鉴别下列物质的方法中,正确的是( )
| A. | 食盐和蔗糖:取样,分别尝味道 | |
| B. | 氧气和氮气:取样,分别闻气味 | |
| C. | 二氧化碳和氮气:取样,用燃着的木条检验 | |
| D. | 过氧化氢溶液和水:取样,分别加入少量二氧化锰 |