题目内容
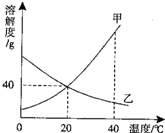 (1)甲、乙两种物质的溶解度曲线如图.
(1)甲、乙两种物质的溶解度曲线如图.(1)20℃时,甲物质的溶解度为
(2)欲将40时℃乙物质的饱和溶液变为不饱和溶液,可采用的方法是
(3)40℃时,将甲、乙两物质的饱和溶液各100g,分别降温到20℃,所得甲物质溶液的质量
(4)下表为KCl在不同温度下的溶解度:
| 温度╱℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 溶解度╱g | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | 51.1 |
②在10℃时,向100g水中加入40g KCl固体,充分混合溶解后所得溶液为
分析:由题目中的甲、乙两种物质的溶解度曲线图可知:
(1)20℃时,甲物质的溶解度;
(2)由图可知,乙物质的溶解度随温度增加而降低,故可知欲将40时℃乙物质的饱和溶液变为不饱和溶液,可采用的方法;
(3)40℃时,将甲、乙两物质的饱和溶液各100g,分别降温到20℃,考虑甲物质和乙物质的溶解度变化情况.
(4)由表中KCl在不同温度下的溶解度可知:
①由上表可推测KCl溶解度随温度变化情况.
②由表中溶解度可知,在10℃时,其溶解度为31.0克,故可知向100g水中加入40gKCl固体,充分混合溶解后所得溶液种类;掌握溶解过程中的玻璃棒的作用;将其温度升高到50℃时,若不考虑溶剂的变化,则可计算该溶液中溶质的质量分数.
(1)20℃时,甲物质的溶解度;
(2)由图可知,乙物质的溶解度随温度增加而降低,故可知欲将40时℃乙物质的饱和溶液变为不饱和溶液,可采用的方法;
(3)40℃时,将甲、乙两物质的饱和溶液各100g,分别降温到20℃,考虑甲物质和乙物质的溶解度变化情况.
(4)由表中KCl在不同温度下的溶解度可知:
①由上表可推测KCl溶解度随温度变化情况.
②由表中溶解度可知,在10℃时,其溶解度为31.0克,故可知向100g水中加入40gKCl固体,充分混合溶解后所得溶液种类;掌握溶解过程中的玻璃棒的作用;将其温度升高到50℃时,若不考虑溶剂的变化,则可计算该溶液中溶质的质量分数.
解答:解:(1)20℃时,甲物质的溶解度为40g;
(2)欲将40时℃乙物质的饱和溶液变为不饱和溶液,可采用的方法是加水或降温;
(3)40℃时,将甲、乙两物质的饱和溶液各100g,分别降温到20℃,由甲物质析出,故所得甲物质溶液的质量<乙物质溶液的质量.
(4)由表中KCl在不同温度下的溶解度可知:
①由上表可推测KCl溶解度随温度的升高而增大.
②在10℃时,因为其溶解度为31.0克,故可知向100g水中加入40gKCl固体,充分混合溶解后所得溶液为饱和溶液;此过程中的玻璃棒的作用为加快溶解速率;将其温度升高到50℃时,若不考虑溶剂的变化,则该溶液中溶质的质量分数为
×100%=28.6%.
故答为:
(1)40;
(2)加水或降温;
(3)<;
(4)①增大 ②饱和 加快溶解速率 28.6%
(2)欲将40时℃乙物质的饱和溶液变为不饱和溶液,可采用的方法是加水或降温;
(3)40℃时,将甲、乙两物质的饱和溶液各100g,分别降温到20℃,由甲物质析出,故所得甲物质溶液的质量<乙物质溶液的质量.
(4)由表中KCl在不同温度下的溶解度可知:
| 温度╱℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 溶解度╱g | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | 51.1 |
②在10℃时,因为其溶解度为31.0克,故可知向100g水中加入40gKCl固体,充分混合溶解后所得溶液为饱和溶液;此过程中的玻璃棒的作用为加快溶解速率;将其温度升高到50℃时,若不考虑溶剂的变化,则该溶液中溶质的质量分数为
| 40 |
| 100+40 |
故答为:
(1)40;
(2)加水或降温;
(3)<;
(4)①增大 ②饱和 加快溶解速率 28.6%
点评:溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度;同一温度下,不同溶质的溶解度;温度对不同物质的溶解度影响不同.

练习册系列答案
相关题目


 (2011?长宁区二模)如图是甲、乙两物质的溶解度曲线:
(2011?长宁区二模)如图是甲、乙两物质的溶解度曲线: (2013?徐州一模)如图1是甲、乙两种物质的溶解度曲线.20℃时,向两支试管中加入等质量的甲、乙两种固体物质,分别加入10g水,使其充分溶解,观察到如图2所示的现象.下列说法不正确的是( )
(2013?徐州一模)如图1是甲、乙两种物质的溶解度曲线.20℃时,向两支试管中加入等质量的甲、乙两种固体物质,分别加入10g水,使其充分溶解,观察到如图2所示的现象.下列说法不正确的是( )