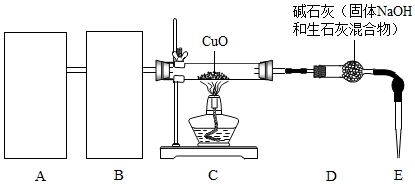
题目内容
4.氧化铜和铜的混合物共10g,用一氧化碳完全还原后铜粉的质量为8.4g.求原混合物中氧化铜的质量分数是多少?分析 用差量法解答本题.由氢气还原氧化铜的化学方程式CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2可以看出,原混合物的质量与还原后共得到铜的质量之差,就是固体减少的质量,据此列出比例式,就可计算出混合物中含氧化铜的质量,然后根据质量分数公式计算出原混合物中含氧化铜的质量分数.
解答 解:设原混合物中含氧化铜的质量为x,
CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 固体质量减少
80 64 80-64=16
x 10g-8.4g=1.6g
$\frac{80}{x}=\frac{16}{1.6g}$
x=8g
则原混合物中含氧化铜的质量分数为:$\frac{8g}{10g}$×100%=80%.
答:原混合物中氧化铜的质量分数是80%.
点评 本题主要考查学生利用差量法和化学方程式解答问题的能力.利用差量法解答有关化学方程式的计算问题,是较常见的一种解题方法,关键是分析清楚差量与物质质量的关系.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
14.AgNO3固体见光或受热易分解,分解时放出的有刺激性气味的气体可能是( )
| A. | SO2 | B. | N2 | C. | NH3 | D. | NO2 |
12.下列关于实验的说法正确的是( )
| A. | 用氯酸钾分解制氧气收集完成后,先停止加热后移导气管 | |
| B. | 硫、铁在氧气中的燃烧实验瓶底要装少量水,但水的作用有差异 | |
| C. | 电解水的实验正极与负极产生的气体的体积比一定是1:2 | |
| D. | 实验室不能用稀硫酸和大理石反应制取二氧化碳,因为它们不发生反应 |
16.砒霜是古代很常见的一种毒.由于古代的生产技术落后,致使砒霜里都伴有少量的硫和硫化物.在古代,用银针可以验毒,反应原理是:4Ag+2H2S+O2═2X+2H2O,X的化学式为( )
| A. | Ag2S | B. | Ag2O2 | C. | AgS | D. | Ag2O |
13.多数金属与其组分金属相比较,具有的性质是( )
| A. | 熔点低,硬度大 | B. | 密度大 | C. | 机械强度差 | D. | 熔点高,硬度小 |

 2016年10月17日,我国的神舟十一号航天飞船成功飞天,并与天宫二号完美对接,航天员景海鹏和陈冬在太空中进行了多项实验,历时33天,顺利返航.
2016年10月17日,我国的神舟十一号航天飞船成功飞天,并与天宫二号完美对接,航天员景海鹏和陈冬在太空中进行了多项实验,历时33天,顺利返航.