题目内容
(2009?宣武区二模)镧的合金是一种储氢材料.下列有关元素镧(La)的说法不正确的是( )
【答案】分析:由上图57号元素镧,可知的信息:该元素的元素符号、相对原子质量、质子数等,然后根据核内质子数=核外电子数可以推出该元素原子电子数.
解答:解:A、该元素原子的质子数为57,未体现中子数的多少,故此选项正确.
B、该元素原子的核电荷数为57,说法正确,原子序数=核电荷数,故此选项错误.
C、该元素原子的核外电子数为57,说法正确,原子序数=核外电子数,故此选项错误.
D、该元素原子的相对原子质量为138.9,由表中可读出相关信息,故此选项错误.
故选A
点评:了解原子的定义和构成;熟记规律:“原子序数=核内质子数=核外电子数=核电荷数”
解答:解:A、该元素原子的质子数为57,未体现中子数的多少,故此选项正确.
B、该元素原子的核电荷数为57,说法正确,原子序数=核电荷数,故此选项错误.
C、该元素原子的核外电子数为57,说法正确,原子序数=核外电子数,故此选项错误.
D、该元素原子的相对原子质量为138.9,由表中可读出相关信息,故此选项错误.
故选A
点评:了解原子的定义和构成;熟记规律:“原子序数=核内质子数=核外电子数=核电荷数”

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
(2009?宣武区二模)某固体混合物的主要成分有碳酸钙和氯化钙(氯化钙不与盐酸反应).为探究混合物中碳酸钙的质量分数,甲、乙两个小组同学分别进行了实验:
(1)甲组同学按以下流程进行实验:

①操作A的名称______.
②混合物中碳酸钙的质量分数可能______80% 或______80%(填“>”、“<”或“=”).
(2)乙组的5名同学分别在一个质量为40.00的空烧杯中加入各自称好的固体混合物,然后将质量分数不同的36.50g稀盐酸加入烧杯中,实验数据如表:(假设反应过程中各物质均没有损失)
表中a=______g.
(1)甲组同学按以下流程进行实验:

①操作A的名称______.
②混合物中碳酸钙的质量分数可能______80% 或______80%(填“>”、“<”或“=”).
(2)乙组的5名同学分别在一个质量为40.00的空烧杯中加入各自称好的固体混合物,然后将质量分数不同的36.50g稀盐酸加入烧杯中,实验数据如表:(假设反应过程中各物质均没有损失)
| 组号 | 烧杯及物质的总质量(g) | 稀盐酸溶质质量分数(%) | 产生气体的质量(g) |
| 1 | 42.00 | 2.00 | 0.44 |
| 2 | 45.00 | 5.00 | 1.10 |
| 3 | 44.00 | 9.50 | 1.32 |
| 4 | 46.00 | 9.50 | 1.98 |
| 5 | 44.00 | 6.00 | a |
(2009?宣武区二模)酸、碱、盐是三类重要物质.
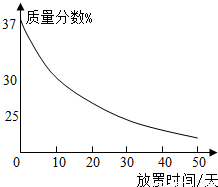
(1)实验室中有一瓶敞口放置的浓盐酸.它的质量分数和放置天数的关系如图.假设水不蒸发,分析浓盐酸的溶质质量分数变化的原因.
(2)观察图片,向小试管内滴加水后,除看到氧化钙固体溶解外,还可观察到的现象是.解释产生此现象的原因;.

(3)如图分别是溴化氢(HBr)和乙醇(C2H5OH)在水中的微观示意图.请你结合已有的酸、碱知识,判断溴化氢的水溶液显,乙醇的水溶液显(填“酸性”、“中性”或“碱性”).

(4)向盛有10mL稀盐酸(其中滴有少量指示剂)的烧杯中加入氢氧化钠溶液,用pH计测定溶液的pH,所得数据如下.请分析并回答下列问题:
①若滴加的指示剂是紫色石蕊溶液,当加入氢氧化钠溶液的体积为13mL时,溶液显色.
②若滴加指示剂是无色酚酞溶液,入氢氧化钠溶液充分振荡后,溶液颜色无变化.此时溶液中的溶质一定有(填化学式);可能有.
(1)实验室中有一瓶敞口放置的浓盐酸.它的质量分数和放置天数的关系如图.假设水不蒸发,分析浓盐酸的溶质质量分数变化的原因.

(2)观察图片,向小试管内滴加水后,除看到氧化钙固体溶解外,还可观察到的现象是.解释产生此现象的原因;.

(3)如图分别是溴化氢(HBr)和乙醇(C2H5OH)在水中的微观示意图.请你结合已有的酸、碱知识,判断溴化氢的水溶液显,乙醇的水溶液显(填“酸性”、“中性”或“碱性”).

(4)向盛有10mL稀盐酸(其中滴有少量指示剂)的烧杯中加入氢氧化钠溶液,用pH计测定溶液的pH,所得数据如下.请分析并回答下列问题:
| 加入NaOH溶液的体积/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | |
| 烧杯中溶液的pH | 1.1 | 1.2 | 1.4 | 1.6 | 2.5 | 7.0 | 11.0 | 12.0 |
②若滴加指示剂是无色酚酞溶液,入氢氧化钠溶液充分振荡后,溶液颜色无变化.此时溶液中的溶质一定有(填化学式);可能有.

 (2009?宣武区二模)A~E是初中化学常见的五种物质,有如下图的转化关系.A是生命之源.“-”表示两端的物质能反应,“→”表示物质间存在转化关系.(部分生成物和反应条件已略去)
(2009?宣武区二模)A~E是初中化学常见的五种物质,有如下图的转化关系.A是生命之源.“-”表示两端的物质能反应,“→”表示物质间存在转化关系.(部分生成物和反应条件已略去)