题目内容
将12.8 g由硫酸铜和铁组成的固体,加入足量的水中充分反应后,滤出固体,干燥后称量得5.2 g,求原先混合物中硫酸铜和铁各是多少克?
解析:
|
解析:(1)其过程包含溶于水和发生置换反应.溶解时,硫酸铜固体质量发生了变化,这一差量不能介入差量法中计算,差量是Fe置换出Cu时产生的.(2)题意只说明是“充分反应”,则有三种可能,恰好完全反应,硫酸铜过量,铁过量.当考虑余下的固体是什么时,则归为两种可能,①余下的是铁和铜;②余下的是铜. ①假设余下的固体是铁和铜(即铁过量),则x g的硫酸铜耗尽,铁的质量为12.8 g-x,置换差量为5.2 g-(12.8 g-x)=x-7.6 g CuSO4+Fe 160 56 64 64-56=8 x x-7.6 g 160∶x=8∶(x-7.6 g) 解得 x=8 g 铁为12.8 g-8 g=4.8 g ②设余下的固体全是铜(即铁不过量),则原有的质量为w g的铁耗完. CuSO4+FeFeSO4+Cu 固体增量 △mg 56 64 8 w 5.2 g-w 56∶w=8∶(5.2 g-w) 解得w=4.55 g,则原有的硫酸铜为12.8-4.55=8.25 g. 此时还要讨论②的可能性.因为8.25 g CuSO4中含Cu元素的质量为8.25 g× |

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案地球上物质种类千差万别,但都有一定的规律可寻:
表一:硫酸的密度和溶质质量分数对照表(20 ℃)
| 密度/g·cm-3) | 1.01 | 1.07 | 1.14 | 1.22 | 1.30 | 1.40 | 1.50 | 1.61 | 1.73 | 1.81 | 1.84 |
| 溶质质量分数/% | 1 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 98 |
表二:氯化钠和碳酸钠晶体的溶解度对照表(0 ℃—30 ℃)
| 温度/℃ 物质 | 0 | 10 | 20 | 30 |
| 氯化钠 | 35.7 g | 35.8 g | 36 g | 36.3 g |
| 碳酸钠晶体 | 7 g | 12.5 g | 21.5 g | 38.8 g |
请你分析上述两个表中的内容,并探究下列问题:
(1)由表一可得出的规律是:________________________________________________。
(2)由表二可得出两种物质溶解度差异的规律是:____________________________________。
(3)我国有许多盐碱湖,湖水中溶有大量的氯化钠和碳酸钠,那里的农民“冬天捞碱、夏天晒盐”。试说明其中的道理:__________________________________________________________。
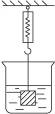
(4)如图,烧杯内盛有不饱和氯化钠溶液,弹簧秤上挂了一块与氯化钠不反应且不溶解的金属块。向氯化钠溶液中加适量氯化钠晶体,则弹簧秤的示数将(填“变大”“变小”或“不变”)____________。
地球上物质种类千差万别,但都有一定的规律可寻:
表一:硫酸的密度和溶质质量分数对照表(20 ℃)
| 密度/g·cm-3) | 1.01 | 1.07 | 1.14 | 1.22 | 1.30 | 1.40 | 1.50 | 1.61 | 1.73 | 1.81 | 1.84 |
| 溶质质量分数/% | 1 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 98 |
表二:氯化钠和碳酸钠晶体的溶解度对照表(0 ℃—30 ℃)
| 温度/℃ 物质 | 0 | 10 | 20 | 30 |
| 氯化钠 | 35.7 g | 35.8 g | 36 g | 36.3 g |
| 碳酸钠晶体 | 7 g | 12.5 g | 21.5 g | 38.8 g |
请你分析上述两个表中的内容,并探究下列问题:
(1)由表一可得出的规律是:________________________________________________。
(2)由表二可得出两种物质溶解度差异的规律是:____________________________________。
(3)我国有许多盐碱湖,湖水中溶有大量的氯化钠和碳酸钠,那里的农民“冬天捞碱、夏天晒盐”。试说明其中的道理:__________________________________________________________。

(4)如图,烧杯内盛有不饱和氯化钠溶液,弹簧秤上挂了一块与氯化钠不反应且不溶解的金属块。向氯化钠溶液中加适量氯化钠晶体,则弹簧秤的示数将(填“变大”“变小”或“不变”)____________。
地球上物质种类千差万别,但都有一定的规律可寻:
表一:硫酸的密度和溶质质量分数对照表(20 ℃)
| 密度/g·cm-3) | 1.01 | 1.07 | 1.14 | 1.22 | 1.30 | 1.40 | 1.50 | 1.61 | 1.73 | 1.81 | 1.84 |
| 溶质质量分数/% | 1 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 98 |
表二:氯化钠和碳酸钠晶体的溶解度对照表(0 ℃—30 ℃)
| 温度/℃ 物质 | 0 | 10 | 20 | 30 |
| 氯化钠 | 35.7 g | 35.8 g | 36 g | 36.3 g |
| 碳酸钠晶体 | 7 g | 12.5 g | 21.5 g | 38.8 g |
请你分析上述两个表中的内容,并探究下列问题:
(1)由表一可得出的规律是:________________________________________________。
(2)由表二可得出两种物质溶解度差异的规律是:____________________________________。
(3)我国有许多盐碱湖,湖水中溶有大量的氯化钠和碳酸钠,那里的农民“冬天捞碱、夏天晒盐”。试说明其中的道理:_________________________________________________________。

(4)如图,烧杯内盛有不饱和氯化钠溶液,弹簧秤上挂了一块与氯化钠不反应且不溶解的金属块。向氯化钠溶液中加适量氯化钠晶体,则弹簧秤的示数将(填“变大”“变小”或“不变”)____________。
 (2011?扬州)某学习小组对硫酸进行如下研究:
(2011?扬州)某学习小组对硫酸进行如下研究: