题目内容
【题目】宣城市区已全面使用天然气,小明通过查阅资料知道天然气的主要成分是甲烷(化学式CH4),他对“甲烷燃烧后的气体产物是什么”产生了兴趣,兴趣小组在老师的指导下进行探究,请你参与并回答下列问题:
(提出问题)甲烷燃烧后生成哪些气体物质?
(查阅资料)①白色无水硫酸铜粉末遇水变蓝色;②含碳元素的物质完全燃烧生成CO2,吸收CO2一般用氢氧化钠溶液;不完全燃烧生成CO,CO有毒,在加热的条件下CO能与红棕色的Fe3O4反应生产Fe(铁粉为黑色)和CO2;③含氢元素的物质燃烧生成H2O。
(猜想假设)猜想Ⅰ:CO2、H2O;猜想Ⅱ:CO、H2O;猜想Ⅲ:_____。
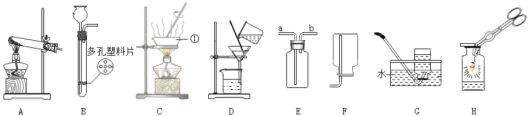
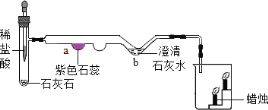
(实验设计)将甲烷在一定量纯净氧气中燃烧的产物依次通过A-E装置(部分夹持、固定装置省略)进行实验:

观察到的现象:①A中白色粉末变为蓝色;②B、E中澄清石灰水浑浊;③D中棕色粉末变成黑色。
(1)猜想_____成立。
(实验结论)(2)根据以上实验现象可推断出猜想_____成立。
(反思交流)(3)装置B的作用是鉴别是否有_____生成,装置C的作用是_____。
(4)实验过程中用纯净的氧气而不用空气的原因是空气中含有_____而影响实验结果。甲烷和氢气都是可燃性气体,点燃前_____。
(实验改进)
(5)请写出D装置中的化学方程式_____。
(6)小明认为图示实验装置有缺陷,还应该在C、D装置之间增加一个装有澄清石灰水的洗气瓶。请你帮小明说明理由_____。
【答案】CO2、CO、H2O Ⅲ CO2 吸收CO2 水蒸气和二氧化碳 要验纯 ![]() 验证是否有残留的CO2没有被吸收
验证是否有残留的CO2没有被吸收
【解析】
[猜想假设]根据质量守恒定律,甲烷分子式为CH4,与O2反应,则生成物为碳氧化合物、氢氧化合物,所以生成物为CO、CO2、H2O的混合物,当氧气足量,则生成CO2、H2O,当氧气少量,则生成CO、H2O,而当氧气适量时,甲烷部分完全燃烧,部分不完全燃烧,则生成物就为CO、CO2、H2O的混合物,所以除了上述两个猜想外,猜想Ⅲ则为三者混合物;
故填:CO2、CO、H2O。
[实验结论]①中硫酸铜变蓝色,说明有水蒸气存在,②澄清石灰水变浑浊说明有二氧化碳存在,③红棕色氧化铁被还原为黑色固体铁,说明有一氧化碳存在,将氧化铁还原,根据三个实验现象推断生成物中有CO2、CO、H2O,所以猜想Ⅲ成立;
故填:Ⅲ。
[反思交流](3)澄清石灰水与二氧化碳生成碳酸钙沉淀,可使石灰水变浑浊,是二氧化碳重要性质,所以用澄清石灰水作为检验二氧化碳的试剂使用,同时二氧化碳可被氢氧化钠吸收,避免混入一氧化碳,对后面实验造成影响;
故填:二氧化碳;吸收CO2。
(4)实验是为了验证甲烷可以与氧气反应生成二氧化碳和水,如果用空气进行燃烧反应,那空气中的二氧化碳与水也可以发生上述的实验现象,不足以证明甲烷与氧气反应可以生成二氧化碳和水;甲烷和氢气都是可燃性气体,点燃前要验纯。
故填:水蒸气和二氧化碳;要验纯。
[实验改进]
(5)D装置中的化学方程式为:![]() ;
;
故填:![]() 。
。
(6)由于二氧化碳的生成量未知,同时加入氢氧化钠溶液的量是否能把二氧化碳全部吸收,而在C、D之间加入一个澄清石灰水的洗气瓶后,可以通过观察澄清石灰有无变浑浊现象,判断二氧化碳是否还有残存。
故填:检验二氧化碳是否被完全吸收。