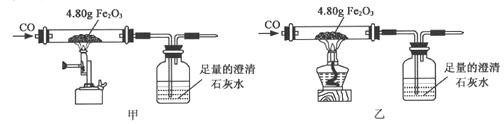
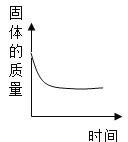
题目内容
【题目】某化学兴趣小组的同学对石灰石与稀盐酸反应后的废液成分进行研究。取废液100g,逐滴滴加10.6%的碳酸钠溶液。用pH传感器测得废液的pH随所加入碳酸钠溶液的质量的变化曲线如图所示。回答下列问题:

(1)废液中含有的溶质有___________(填化学式)。
(2)CD段溶液pH>7的原因是__________;计算废液中氯化钙的质量分数_______。(写出计算过程)。
(3)计算充分反应至C点时所得溶液的质量为______________。
【答案】CaCl2、HCl 溶液中含有碳酸钠且碳酸钠溶液显碱性 1.11%(详见解析) 128.12g
【解析】
根据PH变化可分析反应后溶液的溶质还有过量的盐酸和盐酸先与碳酸钠反应,后与氯化钙反应。
(1)石灰石与稀盐酸反应生成氯化钙、水和二氧化碳,因此溶液中的溶质含有氯化钙,从图中分析,溶液呈酸性,因此溶液中还有剩余的盐酸,因此废液中含有的溶质为氯化钙和氯化氢,化学式为:CaCl2、HCl。
(2)A~B段表示碳酸钠与稀盐酸反应,pH由小变大,B~C段表示碳酸钠与氯化钙反应,pH不变,C~D表示碳酸钠过量,碳酸钠溶液显碱性,因此pH增加;由图分析与氯化钙反应消耗10g碳酸钠溶液,因此CaCl2反应的碳酸钠的质量为10g×10.6%=1.06g,由反应方程式可计算氯化钙的质量;
设100g废液中CaCl2的质量为x,

![]()
x=1.11g
废液中氯化钙的质量分数为![]()
答:100g废液中氯化钙的质量分数为1.11%。
(3)充分反应至C点时所得溶液的质量为原来废液100g,加上A~C参加反应的碳酸钠30g,减去A~B反生成的气体和B~C段生成的沉淀;A~B段表示碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳;从图中分析消耗碳酸钠溶液的质量为20g,因此稀盐酸反应的碳酸钠的质量为20g×10.6%=2.18g;
设生成的二氧化碳质量为x,

![]()
x=0.88g
答:生成的二氧化碳质量为0.88g。
B~C段表示碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠;由图分析与氯化钙反应消耗10g碳酸钠溶液,因此CaCl2反应的碳酸钠的质量为10g×10.6%=1.06g;
设生成碳酸钙的质量为y,

![]()
y=1.0g
答:生成的碳酸钙质量为1.0g。
因此充分反应至C点时所得溶液的质量为:100g+30g-0.88g-1.0g=128.12g。

【题目】有些金属的氢氧化物有相似的化学性质,但物理性质却有所不同,如Ca(OH)2,Ba(OH)2的溶解度就存在一定的差异,如下表所示:
温度/℃ | 0 | 40 | 80 | |
溶解度/g | Ca(OH)2 | 0.187 | 0.141 | 0.094 |
Ba(OH)2 | 1.67 | 8.22 | 101.4 |
根据以上信息回答下列问题.

(1)图中,表示Ca(OH)2溶解度曲线的是______(填“A”或“B”).
(2)如果要将Ca(OH)2的不饱和溶液转为饱和溶液,可采取的方法是______(只举一种).
(3)现有常温时含Ca(OH)2,Ba(OH)2两种溶质的某饱和溶液,若要得到较纯净的Ba(OH)2溶液,采取的物理方法为______.
【题目】(4分)合理运用燃烧与灭火的化学原理对保障生命财产安全非常重要。
(1)2013年12月广州建业大厦发生严重火灾。从燃烧条件分析,大厦内存放的大量鞋、纸箱等物品充当了________________。
(2)高层建筑物通常设计了灭火用的洒水系统。从灭火原理分析,洒水的作用主要是______________。
(3)分析下表中的数据,回答问题:
物质代号 | L | M | N | P |
熔点/℃ | -117 | 3550 | 44 | -259 |
沸点/℃ | 78 | 4827 | 257 | -253 |
着火点/℃ | 510 | 370 | 40 | 580 |
①有人认为“物质的熔、沸点越高,着火点越高”,该结论_______________(填“合理”或“不合理”)。

②已知酒精灯火焰的温度约为500℃。利用上图装置,验证达到可燃物着火点是燃烧的条件之一,上表中可用于完成该实验的两种可燃物是_________和________(填代号)。