题目内容
4.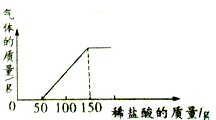 造纸厂平分的废水中含有氢氧化钠和碳酸钠(假设不考虑其他成分),为测定其中碳酸钠的质量分数,某兴趣小组同学取104.4g废水样品于烧杯中并逐滴滴加7.3%的盐酸恰好完全反应,测知有关数据如图所示.
造纸厂平分的废水中含有氢氧化钠和碳酸钠(假设不考虑其他成分),为测定其中碳酸钠的质量分数,某兴趣小组同学取104.4g废水样品于烧杯中并逐滴滴加7.3%的盐酸恰好完全反应,测知有关数据如图所示.(1)样品中氢氧化钠所消耗稀盐酸的质量为50g;
(2)假设样品中碳酸钠的质量分数(写出计算过程);
(3)恰好完全反应时所得溶液中氯化钠的质量分数为7%%(精确到0.1%).
分析 氢氧化钠和稀盐酸反应生成氯化钠和水,碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳;
根据图中提供的数据可以判断氢氧化钠消耗稀盐酸的质量、碳酸钠消耗稀盐酸的质量,再根据稀盐酸的质量分数可以进行相关方面的计算.
解答 解:(1)稀盐酸先和氢氧化钠反应,再和碳酸钠反应,由图中数据可知,样品中氢氧化钠所消耗稀盐酸的质量为50g.
故填:50.
(2)设碳酸钠的质量为x,生成氯化钠质量为y,生成二氧化碳质量为z,
由图中数据可知,碳酸钠消耗稀盐酸的质量为:150g-50g=100g,
Na2CO3+2HCl═2NaCl+H2O+CO2↑,
106 73 117 44
x 100g×7.3% y z
$\frac{106}{x}$=$\frac{73}{100g×7.3%}$=$\frac{117}{y}$=$\frac{44}{z}$,
x=10.6g,y=11.7g,z=4.4g,
样品中碳酸钠的质量分数为:$\frac{10.6g}{104.4g}$×100%=10.2%,
答:样品中碳酸钠的质量分数为10.2%.
(3)设稀盐酸和氢氧化钠反应生成氯化钠的质量为m,
NaOH+HCl═NaCl+H2O,
36.5 58.5
50g×7.3% m
$\frac{36.5}{50g×7.3%}$=$\frac{58.5}{m}$,
m=8.85g,
恰好完全反应时所得溶液中氯化钠的质量分数为:$\frac{11.7g+5.85g}{104.4g+150g-4.4g}$×100%=7%,
故填:7%.
点评 计算溶液质量时,要减去反应生成的二氧化碳的质量,这是容易漏掉的地方,要注意理解.

练习册系列答案
相关题目
14.下列图象能正确反映对应变化关系的是( )
| A. | 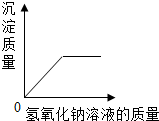 向一定量硫酸铜和硫酸混合液滴入氢氧化钠 | |
| B. | 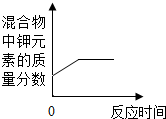 加热一定量氯酸钾 和二氧化锰混合物 | |
| C. | 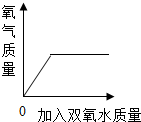 向盛有少量二氧化锰的 烧杯中不断加入双氧水 | |
| D. | 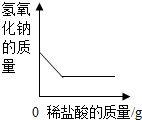 向一定量氢氧化钠溶液中滴入稀盐酸 |
15.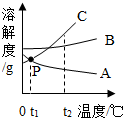 如图为A、B、C三种固体物质的溶解度曲线,下列说法错误的是( )
如图为A、B、C三种固体物质的溶解度曲线,下列说法错误的是( )
 如图为A、B、C三种固体物质的溶解度曲线,下列说法错误的是( )
如图为A、B、C三种固体物质的溶解度曲线,下列说法错误的是( )| A. | A、B、C三种物质的溶解度都随着温度的而升高而增大 | |
| B. | 在t2℃时,C物质的溶解度最大 | |
| C. | 在t1℃时A物质和C物质的溶解度相等 | |
| D. | 根据溶解度曲线图,可得到B物质在某温度下的溶解度 |
19.现有二瓶白色粉末:碳酸钡、硫酸钡.已知它们都不溶于水,请你想出鉴别方法(操作,步骤,结论):
| 分别取少量两种白色粉末于试管中,分别滴加稀盐酸 | 有气泡产生的是碳酸钡,无明显变化的是硫酸钡 |
11.党的十八大报告中把“生态文明建设”首次提升到更高的战略层面,要求加大自然生态系统和环境保护力度.绿色化学有助于解决环境污染问题,下列做法中,不符合绿色化学理念的是( )
| A. |  焚烧小麦秸秆 | B. |  垃圾分类回收 垃圾分类回收 | C. |  拒绝一次性筷子 | D. |  发展太阳能电池 |
8. 食品包装袋中常用脱氧剂.某化学兴趣小组将脱氧剂封口打开,将其倒在滤纸上,
食品包装袋中常用脱氧剂.某化学兴趣小组将脱氧剂封口打开,将其倒在滤纸上,
观察到脱氧剂大部分为黑色粉末,其中还夹杂着少量红色粉末.
【提出问题】该脱氧剂中的黑色、红色粉末各是什么?
【提出猜想】黑色粉末可能含炭粉、铁粉、氧化铜中的一种或几种.红色粉末可能含有氧化铁、铜粉中的一种或几种.
【进行实验】
【得出结论】由实验①②可知,脱氧剂中黑色粉末肯定含铁粉、碳粉.脱氧剂中的红色粉末肯定不含铜,肯定含氧化铁,写出相应的化学方程式Fe2O3+3H2SO4═Fe2(SO4)3+3H2O.
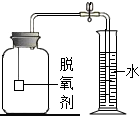
【拓展延伸】小明认为铁生锈时会消耗氧气,因此可用此脱氧剂(实验室可滴几滴水)测定空气中氧气的含量,装置如右图所示.集气瓶的实际容积是150mL,量筒内盛100mL的水.当量筒内水面不再变化,且温度回复至室温时,读出水面在73mL刻度处.由上述实验数据可以算出,空气中氧气的体积分数是18%.本实验的测量结果与理论值不一致,原因可能是脱氧剂不足.
 食品包装袋中常用脱氧剂.某化学兴趣小组将脱氧剂封口打开,将其倒在滤纸上,
食品包装袋中常用脱氧剂.某化学兴趣小组将脱氧剂封口打开,将其倒在滤纸上,观察到脱氧剂大部分为黑色粉末,其中还夹杂着少量红色粉末.
【提出问题】该脱氧剂中的黑色、红色粉末各是什么?
【提出猜想】黑色粉末可能含炭粉、铁粉、氧化铜中的一种或几种.红色粉末可能含有氧化铁、铜粉中的一种或几种.
【进行实验】
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取脱氧剂粉末加入足量稀硫酸 | 粉末几乎全部溶解,只有少量黑色粉末未溶解,有气泡产生,溶液变成黄色 |
| ② | 取实验①的残渣灼烧,将内壁有 澄清石灰水的小烧杯罩在上方 | 澄清石灰水变浑浊 |
【拓展延伸】小明认为铁生锈时会消耗氧气,因此可用此脱氧剂(实验室可滴几滴水)测定空气中氧气的含量,装置如右图所示.集气瓶的实际容积是150mL,量筒内盛100mL的水.当量筒内水面不再变化,且温度回复至室温时,读出水面在73mL刻度处.由上述实验数据可以算出,空气中氧气的体积分数是18%.本实验的测量结果与理论值不一致,原因可能是脱氧剂不足.