题目内容
某混合物由MgSO4和Fe2(SO4)3两种物质组成,经实验测知其中硫元素的质量分数为25%,求混合物中镁元素的质量分数.
答案:
解析:
解析:
|
答案:7.5% 讲析:不论MgSO4和Fe2(SO4)3以何种比例混合,其中S和O原子的个数比恒为1∶4,其质量比恒为32∶16×4=1∶2.根据硫元素的质量分数为25%,可得氧元素的质量分数为50%,则混合物中硫酸根原子团的质量分数为25%+50%=75%,也就是该混合物中镁元素与铁元素的质量分数之和为25%.设混合物总质量为100,则硫酸根原子团的质量为75,设镁的质量为x,则铁的质量为25-x,根据化合价守恒,得 点评:根据“在化合物中,正负化合价的代数和为零”,可推出“在化合物中,正化合价代数和与负化合价代数和的绝对值相等”这一化合价守恒策略,因此在混合物MgSO4和Fe2(SO4)3中,镁原子个数×镁的化合价的绝对值+铁原子个数×铁的化合价的绝对值=硫酸根原子团个数×硫酸根原子团的化合价的绝对值. |

练习册系列答案
相关题目

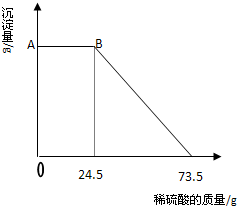 某固体物质由MgSO4和NaOH组成,取24g该固体混合物溶于水后,向所得的混合物中逐滴加入20%的稀硫酸,发现沉淀量与加入硫酸溶液的质量如图所示的关系.
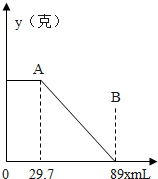
某固体物质由MgSO4和NaOH组成,取24g该固体混合物溶于水后,向所得的混合物中逐滴加入20%的稀硫酸,发现沉淀量与加入硫酸溶液的质量如图所示的关系.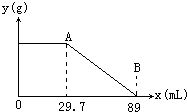 某固体物质由MgSO4和NaOH组成,取24.0g该固体混合物溶于水后,向所得的混合物中逐滴加入质量分数为15%的硫酸溶液(密度为1.1g?mL-1),加入的稀H2SO4的体积x(单位:mL)与所得沉淀质量y(单位;g)有如图所示的关系,求该固体混合物中NaOH、MgSO4的质量各为多少克?
某固体物质由MgSO4和NaOH组成,取24.0g该固体混合物溶于水后,向所得的混合物中逐滴加入质量分数为15%的硫酸溶液(密度为1.1g?mL-1),加入的稀H2SO4的体积x(单位:mL)与所得沉淀质量y(单位;g)有如图所示的关系,求该固体混合物中NaOH、MgSO4的质量各为多少克?