题目内容
 如图是某硫酸试剂瓶标签上的部分文字.下列说法正确的是
如图是某硫酸试剂瓶标签上的部分文字.下列说法正确的是
- A.打开该试剂瓶瓶塞,有白雾产生
- B.该瓶硫酸中溶质的质量是490g
- C.该硫酸与等体积水混合所得溶液的溶质质量分数大于49%
- D.若将其看做纯净物,化学式可表示为H2SO4?H2O
C
分析:A.根据浓硫酸不具有挥发性分析;
B.根据溶液中溶质的质量=溶液的质量×溶质质量分数分析;
C.根据水的密度比硫酸的密度小,等体积混合时,硫酸的质量大于水的质量分析;
D.根据若质量分数为98%的浓H2SO4的质量为100g,则溶质H2SO4质量为98g,溶剂H2O的质量为2g,从而计算分析出化学式.
解答:A.浓硫酸不具有挥发性,打开该试剂瓶瓶塞,没有白雾产生,故A说法错误;
B.该瓶硫酸中溶质的质量是1.84g/mL×500mL×98%=901.6g,故B说法错误;
C.水的密度比硫酸的密度小,等体积混合时,硫酸的质量大于水的质量,所以该硫酸与等体积的水混合所得溶液的质量分数大于49%,故C说法正确;
D.若质量分数为98%的浓H2SO4的质量为100g,则溶质H2SO4质量为98g,n(H2SO4)=1mol,溶剂H2O的质量为2g,n(H2O)= =
=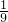 mol,故n(H2SO4):n(H2O)=9:1,故质量分数为98%的浓H2SO4看做纯净物,化学式可表示为9H2SO4?H2O,故D说法错误;
mol,故n(H2SO4):n(H2O)=9:1,故质量分数为98%的浓H2SO4看做纯净物,化学式可表示为9H2SO4?H2O,故D说法错误;
故选C.
点评:本题考查物质的量浓度的计算,明确信息,并熟悉溶液配制、化学式的表示法等,题目难度不大.
分析:A.根据浓硫酸不具有挥发性分析;
B.根据溶液中溶质的质量=溶液的质量×溶质质量分数分析;
C.根据水的密度比硫酸的密度小,等体积混合时,硫酸的质量大于水的质量分析;
D.根据若质量分数为98%的浓H2SO4的质量为100g,则溶质H2SO4质量为98g,溶剂H2O的质量为2g,从而计算分析出化学式.
解答:A.浓硫酸不具有挥发性,打开该试剂瓶瓶塞,没有白雾产生,故A说法错误;
B.该瓶硫酸中溶质的质量是1.84g/mL×500mL×98%=901.6g,故B说法错误;
C.水的密度比硫酸的密度小,等体积混合时,硫酸的质量大于水的质量,所以该硫酸与等体积的水混合所得溶液的质量分数大于49%,故C说法正确;
D.若质量分数为98%的浓H2SO4的质量为100g,则溶质H2SO4质量为98g,n(H2SO4)=1mol,溶剂H2O的质量为2g,n(H2O)=
 =
=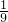 mol,故n(H2SO4):n(H2O)=9:1,故质量分数为98%的浓H2SO4看做纯净物,化学式可表示为9H2SO4?H2O,故D说法错误;
mol,故n(H2SO4):n(H2O)=9:1,故质量分数为98%的浓H2SO4看做纯净物,化学式可表示为9H2SO4?H2O,故D说法错误;故选C.
点评:本题考查物质的量浓度的计算,明确信息,并熟悉溶液配制、化学式的表示法等,题目难度不大.

练习册系列答案
相关题目