题目内容
实验室用锌粒和稀硫酸反应制取氢气,并经过净化、干燥后,还原氧化铜来测定铜的相对原子质量.根据所得到的铜粉的质量,可求得参加反应的氢气的质量,进而计算出应消耗的锌粒和稀硫酸的质量.但实验耗用的锌粒(不含杂质)和稀硫酸的质量都远远超过计算值.试从实验过程看,原因是________.
氧化铜加热前要先通氢气,排去试管内空气;反应后热铜粉还需在氢气中冷却;部分氢气通过装有氧化铜的试管时,未与氧化铜反应
分析:可燃性的气体与氧气混合达到一定程度时,遇明火会发生爆炸;
铜在高温条件下能和氧气反应生成氧化铜.
解答:实验耗用的锌粒和稀硫酸的质量都远远超过计算值,试从实验过程看,原因是氧化铜加热前要先通氢气,排去试管内空气;反应后热铜粉还需在氢气中冷却;部分氢气通过装有氧化铜的试管时,未与氧化铜反应.
故填:氧化铜加热前要先通氢气,排去试管内空气;反应后热铜粉还需在氢气中冷却;部分氢气通过装有氧化铜的试管时,未与氧化铜反应.
点评:解答本题要理解反应生成的氢气一部分用于排空气,一部分用于冷却铜,一部分没有与氧化铜反应.
分析:可燃性的气体与氧气混合达到一定程度时,遇明火会发生爆炸;
铜在高温条件下能和氧气反应生成氧化铜.
解答:实验耗用的锌粒和稀硫酸的质量都远远超过计算值,试从实验过程看,原因是氧化铜加热前要先通氢气,排去试管内空气;反应后热铜粉还需在氢气中冷却;部分氢气通过装有氧化铜的试管时,未与氧化铜反应.
故填:氧化铜加热前要先通氢气,排去试管内空气;反应后热铜粉还需在氢气中冷却;部分氢气通过装有氧化铜的试管时,未与氧化铜反应.
点评:解答本题要理解反应生成的氢气一部分用于排空气,一部分用于冷却铜,一部分没有与氧化铜反应.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
结合图示实验装置,回答下列问题.
(1)写出图中标号仪器的名称① ;② ;③ .
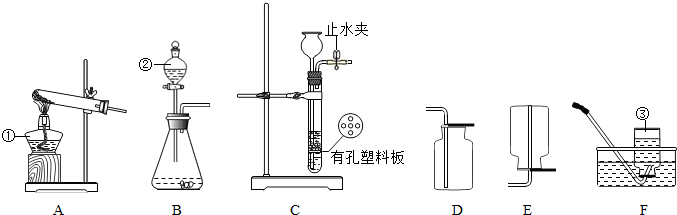
(2)实验室用锌粒和稀硫酸制取氢气的化学方程式为: .
若用C装置制取氢气,检查气密性的方法是 ,要想使该装置能更有效地达到控制反应的发生和停止,应将锌粒放在有孔塑料板的 (填“上面”或“下面”),其原理是 .
(3)实验室常用加热氢氧化钙固体和氯化铵固体混合物的方法来制取氨气,已知氨气的密度小于空气,易溶于水且能和水反应.则实验室制取氨气的发生装置为 (填字母编号,下同),收集装置为 .
(4)实验室用二氧化锰催化双氧水制取氧气,发生装置为 (从“A、B”中选择),收集装置为 ,反应的化学方程式为: .
(5)某化学兴趣小组同学想探究FeCl3溶液是否对过氧化氢的分解具有催化作用.
①请你帮助他们完成实验报告:
②经分析知:FeCl3溶液中存在H20、Fe3+和Cl-三种微粒,于是同学们提出了以下猜想:
甲同学:催化分解H202的是FeCl3溶液中的H20;
乙同学:催化分解H202的是FeCl3溶液中的Fe3+;
丙同学:催化分解H202的是FeCl3溶液中的Cl-.
你认为最不可能的是 同学的猜想,理由是 .
③同学们对余下的两个猜想,用实验进行了探究.请你仔细分析后填表:
(1)写出图中标号仪器的名称①

(2)实验室用锌粒和稀硫酸制取氢气的化学方程式为:
若用C装置制取氢气,检查气密性的方法是
(3)实验室常用加热氢氧化钙固体和氯化铵固体混合物的方法来制取氨气,已知氨气的密度小于空气,易溶于水且能和水反应.则实验室制取氨气的发生装置为
(4)实验室用二氧化锰催化双氧水制取氧气,发生装置为
(5)某化学兴趣小组同学想探究FeCl3溶液是否对过氧化氢的分解具有催化作用.
①请你帮助他们完成实验报告:
| 实验过程 | 实验现象 | 实验结论 |
| 在一支试管中加5%的H202溶液,然后滴人适量的FeCl3溶液,把带火星的木条伸入试管. | FeCl3溶液可以 催化分解H202 |
甲同学:催化分解H202的是FeCl3溶液中的H20;
乙同学:催化分解H202的是FeCl3溶液中的Fe3+;
丙同学:催化分解H202的是FeCl3溶液中的Cl-.
你认为最不可能的是
③同学们对余下的两个猜想,用实验进行了探究.请你仔细分析后填表:
| 实验过程 | 实验现象 | 结论 |
| 向盛有5%的H202溶液的试管中加入少量的盐酸(含有Cl-),并把带火星的木条伸人试管. | 无明显现象 | |
| 向盛有5%的H202溶液的试管中加入少量的Fe2(S04)3溶液(含有Fe3+),并把带火星的木条伸人试管. |


