题目内容
【题目】硫酸亚铁是一种重要的食品和饲料添加剂,某补血剂样品【主要成分为硫酸亚铁晶体(FeSO4xH2O)】,某化学兴趣小组对其产生了兴趣并进行了探究:
【探究一】硫酸亚铁晶体(FeSO4xH2O)热分解研究
【查阅资料】
①无水硫酸铜粉末遇水会变成蓝色的硫酸铜晶体;
②硫酸亚铁晶体加热时,先失去结晶水,高温会继续分解产生金属氧化物和气态非金属氧化物。
③二氧化硫能使高锰酸钾溶液褪色。
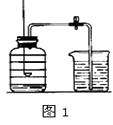
【进行实验】该兴趣小组同学称取27.8g硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行分析,并利用SDTQ600热分析仪,对硫酸亚铁晶体热分解获得相关数据,绘制成图2所示的关系图,试回答:
(1)装置B中硫酸铜粉末变蓝,说明产物中有 , 该物质的质量是g;装置C中高锰酸钾溶液褪色,说明产物中还有;硫酸亚铁晶体完全分解后,装置A中的固体呈红棕色,放入足量稀盐酸,固体全部溶解,且得到黄色溶液,则该红棕色固体与稀盐酸反应的化学方程式为。
(2)D装置中球形干燥管的作用是。
(3)硫酸亚铁分解生成铁的氧化物和硫的两种氧化物,请写出化学反应方程式。
(4)根据图2中的数据,请求出FeSO4xH2O中的x=。(不写过程)
(5)【交流讨论】实验中要持续通入氮气,否则测出的x会 (填“偏大”、“偏小”或“不变”)。
(6)【探究二】补血剂样品中硫酸亚铁的含量:
①取10g补血剂样品研细后溶于40g水中,研细的目的是;
②向所配制的溶液中加氯化钡溶液至略过量,使其充分反应;
③过滤,洗涤,干燥,称量所得白色固体的质量为6.99g。
请计算出10g样品中FeSO4的质量分数,写出计算过程。
(已知:FeSO4+BaCl2=BaSO4↓+FeCl2 , 有关相对分子质量:FeSO4—152,BaSO4—233)
【答案】
(1)水,12.6g,SO2,Fe2O3+6HCl=2FeCl3+3H2O
(2)防止NaOH溶液倒吸
(3)2FeSO4=Fe2O3+SO2↑+SO3↑
(4)x=7
(5)偏小
(6)增大接触面积,使其充分溶解,设样品中FeSO4的质量分数为X
FeSO4+BaCl2= | BaSO4↓+FeCl2 |
152 | 233 |
10x | 6.99g |
列比例式得: ![]() 解得X=45.6%。
解得X=45.6%。
【解析】解:(1)装置B中硫酸铜粉末变蓝,说明产物中有水,硫酸铜粉末遇到水后会变为蓝色,图1装置B中无水硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,生成水的质量是12.6g.该物质的质量是12.6g;装置C中高锰酸钾溶液褪色,说明产物中还有SO2;硫酸亚铁晶体完全分解后,装置A中的固体呈红棕色,放入足量稀盐酸,固体全部溶解,且得到黄色溶液,则该红棕色固体与稀盐酸反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O。
(2)D装置中球形干燥管的作用是防止NaOH溶液倒吸。(3)硫酸亚铁分解生成铁的氧化物和硫的两种氧化物,化学反应方程式2FeSO4=Fe2O3+SO2↑+SO3↑。(4)图1装置B中无水硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,生成水的质量是12.6g.生成的氧化铁的质量是8g.通过FeSO4xH2O的化学式可知铁原子和水的个数比为1:x
Fe2O3~ | 2xH2O |
160 | 36x |
8g | 12.6g |
列比例式得: ![]()
解得:x=7;
(5)实验中要持续通入氮气,将生成的水蒸气全部排出,否则测出的x值会偏小;
(6)取10g补血剂样品研细后溶于40g水中,研细的目的是:增大接触面积,使其充分溶解;
故答案为:(1)水;12.6g;SO2;Fe2O3+6HCl=2FeCl3+3H2O;(2)防止NaOH溶液倒吸;(3)2FeSO4=Fe2O3+SO2↑+SO3↑;(4)x=7;(5)偏小;(6)增大接触面积,使其充分溶解;FeSO4的质量分数45.6%。
【探究一】从含有硫酸铝、硫酸亚铁和硫酸铜的废水中回收铜和硫酸亚铁,加入的过量的金属A应是铁,根据铁与硫酸铜的反应写出①的反应的方程式,分析固体甲的成分及溶液乙中的溶质;
【探究二】由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量;
【探究三】(5)有无水硫酸铜粉末变蓝,说明产物中有水,水的质量为12.6g,根据水和氧化铁的质量求x的值;根据实验中要持续通入氮气的作用,分析x的变化;二氧化硫能使高锰酸钾溶液褪色;
(6)据题意分析红棕色固体为氧化铁,故硫酸亚铁完全分解后得三种产物。