题目内容
化学课外兴趣活动小组的同学对某炼铁厂生产的生铁进行组成分析.取生铁样品与足量的稀盐酸在烧杯中反应(假设生铁中的杂质不与酸反应,也不溶于水),其实验数据如下表:(有关反应的化学方程式为:Fe+2HCl=FeCl2+H2↑)
| 反应前 | 反应后 | ||
| 实验数据 | 稀盐酸的质量 | 生铁样品的质量 | 反应后烧杯中混合物的质量 |
| 200g | 14.5g | 214.0g | |
(2)计算该生铁样品中铁的质量分数.
解:产生氢气的质量:(200g+14.5g)-214g=0.5g;故填:0.5;
(2)设生铁中Fe的质量为x.
Fe+2HCl=FeCl2+H2↑
56 2
x 0.5 g

x=14 g
该生铁样品中铁的质量分数=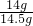 ×100%=96.6%
×100%=96.6%
答:该生铁样品中铁的质量分数为96.6%.
分析:根据反应前后质量减少的就是生成氢气的质量,利用生成氢气的质量可以求出铁的质量,根据铁的质量可以求出生铁中铁的质量分数.
点评:解答本题要掌握化学方程式计算的方法,只有这样才能对相关方面的问题做出正确的判断.
(2)设生铁中Fe的质量为x.
Fe+2HCl=FeCl2+H2↑
56 2
x 0.5 g

x=14 g
该生铁样品中铁的质量分数=
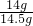 ×100%=96.6%
×100%=96.6% 答:该生铁样品中铁的质量分数为96.6%.
分析:根据反应前后质量减少的就是生成氢气的质量,利用生成氢气的质量可以求出铁的质量,根据铁的质量可以求出生铁中铁的质量分数.
点评:解答本题要掌握化学方程式计算的方法,只有这样才能对相关方面的问题做出正确的判断.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目