题目内容
如图,为氯化钠、碳酸钠(俗称纯碱)在水中的溶解度曲线.(1)当温度为10℃时,碳酸钠的溶解度为;
(2)当温度℃时,氯化钠的溶解度小于碳酸钠的溶解度;
(3)生活在盐湖附近人们习惯“夏天晒盐,冬天捞碱”.请你解释:
“夏天晒盐”;
“冬天捞碱”.
(4)10℃时,向两只盛有100g水的烧杯中,分别加入氯化钠、碳酸钠两种物质至不能溶解为止,所得溶液的溶质质量分数较大的是溶液(填物质化学式).
(5)30℃时,欲配制等质量的氯化钠、碳酸钠两种物质的饱和溶液,所需水的质量关系是氯化钠碳酸钠.(填写“>”、“<”或“=”,下同)
(6)将40℃的氯化钠、碳酸钠两种物质的饱和溶液各200g,降温至10℃,析出晶体的质量关系是氯化钠碳酸钠.

【答案】分析:根据固体物质的溶解度曲线可以:①查出某物质在某温度时的溶解度,②比较不同物质在同一温度下的溶解度大小,从而确定饱和溶液中溶质的质量分数的大小,③判断出物质的溶解度随温度变化的变化情况,从而确定通过蒸发溶剂还是降温结晶的方法使溶质从溶液中结晶析出,确定等量的饱和溶液中溶质的质量的多少.
解答:解:(1)根据碳酸钠的溶解度曲线可知,在10℃时,碳酸钠的溶解度是10g,故答案为:10g
(2)有两物质的溶解度曲线可知,在温度大于30℃时,氯化钠的溶解度小于碳酸钠的溶解度,故答案为:大于30℃
(3)由于氯化钠的溶解度受温度的影响不大,因此从氯化钠溶液中得到氯化钠适合用蒸发溶剂的方法;而碳酸钠的溶解度随温度的降低明显减小,因此碳酸钠从溶液中结晶析出,最好用降温结晶的方法;故答案为:夏天温度高,利于水分蒸发,常用于晒盐;冬天温度低,纯碱易从水中析出,可以用捞的方法得到纯碱.
(4)由于在10℃时,氯化钠的溶解度大于碳酸钠的溶解度,因此两物质的饱和溶液中溶质的质量分数氯化钠>碳酸钠,故答案为:NaCl
(5)由于在30℃时,两物质的溶解度相等,即在30℃时两物质的饱和溶液中溶质的质量分数相等,因此在等量的两物质的饱和溶液中溶质的质量相等,故答案为:=
(6)由于碳酸钠的溶解度随温度的升高而明显增大,而氯化钠的溶解度受温度影响较小,因此将40℃的氯化钠、碳酸钠两种物质的饱和溶液各200g,降温至10℃时,析出的碳酸钠较多,故答案为:<
点评:本题有一定的难度,主要考查了根据物质的溶解度曲线解决相关的问题,从而培养学生分析问题、解决问题的能力.
解答:解:(1)根据碳酸钠的溶解度曲线可知,在10℃时,碳酸钠的溶解度是10g,故答案为:10g
(2)有两物质的溶解度曲线可知,在温度大于30℃时,氯化钠的溶解度小于碳酸钠的溶解度,故答案为:大于30℃
(3)由于氯化钠的溶解度受温度的影响不大,因此从氯化钠溶液中得到氯化钠适合用蒸发溶剂的方法;而碳酸钠的溶解度随温度的降低明显减小,因此碳酸钠从溶液中结晶析出,最好用降温结晶的方法;故答案为:夏天温度高,利于水分蒸发,常用于晒盐;冬天温度低,纯碱易从水中析出,可以用捞的方法得到纯碱.
(4)由于在10℃时,氯化钠的溶解度大于碳酸钠的溶解度,因此两物质的饱和溶液中溶质的质量分数氯化钠>碳酸钠,故答案为:NaCl
(5)由于在30℃时,两物质的溶解度相等,即在30℃时两物质的饱和溶液中溶质的质量分数相等,因此在等量的两物质的饱和溶液中溶质的质量相等,故答案为:=
(6)由于碳酸钠的溶解度随温度的升高而明显增大,而氯化钠的溶解度受温度影响较小,因此将40℃的氯化钠、碳酸钠两种物质的饱和溶液各200g,降温至10℃时,析出的碳酸钠较多,故答案为:<
点评:本题有一定的难度,主要考查了根据物质的溶解度曲线解决相关的问题,从而培养学生分析问题、解决问题的能力.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
海洋是个巨大的宝库,为人类提供了宝贵的自然资源.
(1)食用海鱼摄取的主要营养素是________.
(2)如图1为海水淡化装置,利用的能源是________,获得的蒸馏水属于________.
A.单质 B.化合物 C.混合物
(3)利用海水可制取许多化工产品.用海水制食盐,常通过海水晒盐得到粗盐,粗盐中含有少量的CaCl2、Na2SO4等杂质.除去上述杂质,先加过量的BaCl2溶液除去,再加过量________溶液除去CaCl2和过量的BaCl2,生成的沉淀经________除去,最后加入________调节pH,蒸发、结晶,制得粗盐.
(4)用氯化钠和碳酸氢铵可制备碳酸氢钠和氯化铵,该反应化学方程式可表示为;NaCl+NH4HCO3=NaHCO3+NH4Cl.20℃时,按上述化学方程式中反应物的质量比,向100克水中加入11.7克NaCl和15.8克NH4HCO3,理论上从溶液中提出晶体的质量为________g.
资料:20℃时四种物质的溶解度如下:假设它们同时溶解在水中各自的溶解度不变,
| 物质 | NaCl | NH4CO3 | NH4Cl | NaHCO3 |
| 溶解度 | 36.0 | 21.6 | 37.2 | 9.6 |
①写出氯气置换出溴单质的化学方程式;________;该反应在pH=3的酸性条件下进行,可用________测定反应液的酸碱度.
②吹出的溴和大量空气混合在一起进入吸收塔(吸收塔中发生的反应;Br2+SO2+2H2O?H2SO4+2HBr).根据流程图分析,通入SO2的目的是________.

海洋是个巨大的宝库,为人类提供了宝贵的自然资源.
(1)食用海鱼摄取的主要营养素是 .
(2)如图1为海水淡化装置,利用的能源是 ,获得的蒸馏水属于 .
A.单质 B.化合物 C.混合物
(3)利用海水可制取许多化工产品.用海水制食盐,常通过海水晒盐得到粗盐,粗盐中含有少量的CaCl2、Na2SO4等杂质.除去上述杂质,先加过量的BaCl2溶液除去,再加过量 溶液除去CaCl2和过量的BaCl2,生成的沉淀经 除去,最后加入 调节pH,蒸发、结晶,制得粗盐.
(4)用氯化钠和碳酸氢铵可制备碳酸氢钠和氯化铵,该反应化学方程式可表示为;NaCl+NH4HCO3=NaHCO3+NH4Cl.20℃时,按上述化学方程式中反应物的质量比,向100克水中加入11.7克NaCl和15.8克NH4HCO3,理论上从溶液中提出晶体的质量为 g.
资料:20℃时四种物质的溶解度如下:假设它们同时溶解在水中各自的溶解度不变,
(5)从海水中提取溴常用吹出法,即用氯气将海水里的溴化钠中的溴置换出来,再用空气或水蒸气吹出溴.流程示意图如图2:
①写出氯气置换出溴单质的化学方程式; ;该反应在pH=3的酸性条件下进行,可用 测定反应液的酸碱度.
②吹出的溴和大量空气混合在一起进入吸收塔(吸收塔中发生的反应;Br2+SO2+2H2O?H2SO4+2HBr).根据流程图分析,通入SO2的目的是 .

(1)食用海鱼摄取的主要营养素是 .
(2)如图1为海水淡化装置,利用的能源是 ,获得的蒸馏水属于 .
A.单质 B.化合物 C.混合物
(3)利用海水可制取许多化工产品.用海水制食盐,常通过海水晒盐得到粗盐,粗盐中含有少量的CaCl2、Na2SO4等杂质.除去上述杂质,先加过量的BaCl2溶液除去,再加过量 溶液除去CaCl2和过量的BaCl2,生成的沉淀经 除去,最后加入 调节pH,蒸发、结晶,制得粗盐.
(4)用氯化钠和碳酸氢铵可制备碳酸氢钠和氯化铵,该反应化学方程式可表示为;NaCl+NH4HCO3=NaHCO3+NH4Cl.20℃时,按上述化学方程式中反应物的质量比,向100克水中加入11.7克NaCl和15.8克NH4HCO3,理论上从溶液中提出晶体的质量为 g.
资料:20℃时四种物质的溶解度如下:假设它们同时溶解在水中各自的溶解度不变,
| 物质 | NaCl | NH4CO3 | NH4Cl | NaHCO3 |
| 溶解度 | 36.0 | 21.6 | 37.2 | 9.6 |
①写出氯气置换出溴单质的化学方程式; ;该反应在pH=3的酸性条件下进行,可用 测定反应液的酸碱度.
②吹出的溴和大量空气混合在一起进入吸收塔(吸收塔中发生的反应;Br2+SO2+2H2O?H2SO4+2HBr).根据流程图分析,通入SO2的目的是 .

 (2013?克拉玛依二模)某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图)的溶液,他们对此产生了兴趣.
(2013?克拉玛依二模)某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图)的溶液,他们对此产生了兴趣.
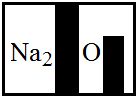 (2013?信阳一模)某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图所示)的溶液,他们对此产生了兴趣.
(2013?信阳一模)某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图所示)的溶液,他们对此产生了兴趣.