题目内容
【题目】有一包固体粉末,其中含有碳酸钠、氢氧化钠、碳酸钙、生石灰、氯化钠中的四种物质。某兴趣小组为确定其组成设计并进行如下实验。
【实验一】甲组同学进行如下探究。请完成表中空白。
实验操作 | 实验现象 | 实验结论及分析 |
I.取少量该固体粉末于烧杯中,加入足量的水溶解、过滤 | 粉末部分溶解,得到白色滤渣和无色滤液 | 滤渣中一定含有 |
Ⅱ.向滤液中粉末部分溶解,得到白色滤渣试液 | 溶液变红 | 滤液中可能含有 物质(填“酸性”、“碱性”或“中性”) |
Ⅲ.向Ⅱ中所得溶液滴加足量稀盐酸 | 原固体粉末中一定含有Na2CO3 |
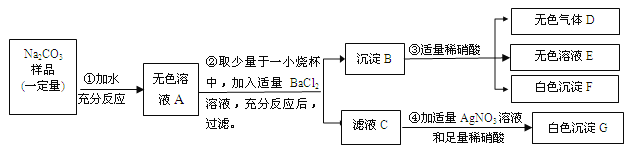
【实验二】乙组同学进行如下探究。

实验测得固体B中含15 g氯元素。
试综合甲、乙两组同学的实验进行分析,填空。(C-12 O-16 Na-23 Cl-35.5)
⑴乙组实验中一定发生的化学反应是:Na2CO3+2HCl=2NaCl+H2O+CO2↑
⑵该固体粉末的组成可能是 。.
【答案】Ⅰ.碳酸钙 (写化学式也可。下同)
Ⅱ.碱性
Ⅲ.产生大量气泡,溶液由红色变无色
(1)CaCO3+2HCl = CaCl2+H2O+CO2↑
(2)Na2CO3、NaCl、CaCO3、NaOH;Na2CO3、NaCl、CaCO3、CaO
【解析】
试题分析:【实验一】粉末部分溶解,得到白色滤渣,说明含有碳酸钙;粉末部分溶解,得到白色滤渣,溶液变成红色,说明溶液呈碱性,可能含有碳酸钠或氢氧化钠或氧化钙;若含有碳酸钠,加盐酸会产生气泡,由于生成的是氯化钠,故溶液还会由红色变成无色。
【实验二】根据实验1可知,固体中还含有碳酸钙,故加入的盐酸还能与碳酸钙反应:CaCO3+2HCl = CaCl2+H2O+CO2↑;因100 g15%的稀盐酸中含有氯元素100g×15%×(35.5/36.5)×100%=14.6g,小于实验测得的氯元素15g,故该粉末中一定含有氯化钠,故该未知粉末的组成可能是Na2CO3、NaCl、CaCO3、NaOH;Na2CO3、NaCl、CaCO3、CaO。

 阅读快车系列答案
阅读快车系列答案