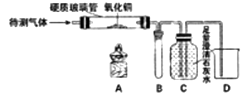
题目内容
【题目】对物质的性质进行比较归纳,有利于更好的学习化学。
温度℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | |
溶 | 氢氧化钠 | 51 | 109 | 119 | 129 | 145 | 174 | 299 | 314 | 329 |
氢氧化钙 | 0.17 | 0.16 | 0.15 | 0.14 | 0.13 | 0.12 | 0.105 | 0.095 | 0.08 | |
(1)分析数据:相同温度下的饱和溶液中,氢氧化钠溶液中溶质质量分数氢氧化钙溶液中溶质质量分数(选填“>”、“<”、“=”)。
(2)实验探究:向充满二氧化碳的塑料瓶中分别倒入等量的水、澄清石灰水、氢氧化钠饱和溶液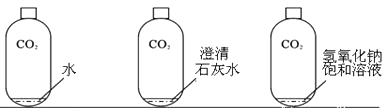
瓶1变瘪(选填“能”或“不能”)说明二氧化碳和水发生化学反应,你的理由是。
(3)实验中,观察到只有瓶2中液体变浑浊,用化学方程式表示其原理。瓶2和瓶3塑料瓶均变瘪,但瓶3变形更为明显,原因是。
(4)取塑料瓶3中反应后的溶液,甲同学滴加足量的稀盐酸,如果有 , 说明有新物质产生,证明CO2与NaOH发生了反应。乙同学选择了一种盐溶液,丙同学也选择了一种溶液,该溶液中溶质与甲、乙同学所用溶液中溶质的物质类别不同,他们都能达到检验目的。你认为丙同学所选溶液中的溶质可能是(填一种物质的化学式)。
(5)兴趣小组的同学对塑料瓶3反应后的液体进行探究。
【提出问题】该溶液中含有哪些溶质?
【作出猜想】猜想Ⅰ溶质为NaOH
猜想Ⅱ:溶质为Na2CO3
猜想Ⅲ:溶质为NaOH和Na2CO3
【实验探究】同学们在老师的带领下设计实验,对猜想进行验证。
方案1:蘸取少量溶液滴到pH试纸上,与标准比色卡比较,pH大于7,有同学认为溶液中一定含有NaOH。
方案2:先向溶液中加入溶液,看到有白色沉淀产生,该反应的化学方程式为;然后向上层清液中加入溶液,看到溶液呈红色,验证了猜想Ⅲ是正确的。
(6)【实验反思】由方案2的结果可知,方案1的结论错误,理由是。
【答案】
(1)>
(2)不能,二氧化碳能溶于水,也能使瓶内压强减小
(3)CO2+Ca(OH)2=CaCO3↓+H2O,NaOH饱和溶液的浓度大吸收的CO2气体更多
(4)气泡产生,Ca(OH)2或 Ba(OH)2
(5)足量的BaCl2(答案合理也给分),Na2CO3+BaCl2=BaCO3↓+2NaCl,无色酚酞
(6)Na2CO3溶液也显碱性
【解析】(1)分析数据:相同温度下氢氧化钠的溶解度大于氢氧化钙的溶解度,据饱和时质量分数的计算式 ![]() ×100%,可知溶解度越大质量分数也就越大,故填:>;(2)瓶1变瘪是二氧化碳气体溶于水造成的,故填:不能;理由是:二氧化碳能溶于水,也能使瓶内压强减小;(3)实验中,观察到只有瓶2中液体变浑浊,是二氧化碳与澄清石灰水反应产生白色沉淀,用化学方程式表示其原理:CO2+Ca(OH)2=CaCO3↓ +H2O,瓶2和瓶3塑料瓶均变瘪,但瓶3变形更为明显,原因是:NaOH饱和溶液的浓度大吸收的CO2气体更多;(4)取塑料瓶3中反应后的溶液,甲同学滴加足量的稀盐酸,有气泡产生,说明NaOH与空气中的CO2反应变质,生成Na2CO3;由于甲同学选用稀盐酸,乙同学选用一种盐溶液,所以丙同学可以选用碱溶液,由于要检验是否有
×100%,可知溶解度越大质量分数也就越大,故填:>;(2)瓶1变瘪是二氧化碳气体溶于水造成的,故填:不能;理由是:二氧化碳能溶于水,也能使瓶内压强减小;(3)实验中,观察到只有瓶2中液体变浑浊,是二氧化碳与澄清石灰水反应产生白色沉淀,用化学方程式表示其原理:CO2+Ca(OH)2=CaCO3↓ +H2O,瓶2和瓶3塑料瓶均变瘪,但瓶3变形更为明显,原因是:NaOH饱和溶液的浓度大吸收的CO2气体更多;(4)取塑料瓶3中反应后的溶液,甲同学滴加足量的稀盐酸,有气泡产生,说明NaOH与空气中的CO2反应变质,生成Na2CO3;由于甲同学选用稀盐酸,乙同学选用一种盐溶液,所以丙同学可以选用碱溶液,由于要检验是否有 ![]() 生成,故所选碱溶液中应含有
生成,故所选碱溶液中应含有 ![]() 或
或 ![]() ,因此所选溶液为:Ca(OH)2或 Ba(OH)2;
,因此所选溶液为:Ca(OH)2或 Ba(OH)2;
【实验探究】由于验证了猜想Ⅲ是正确的,要检验溶液中是否有 ![]() 生成且不能改变溶液的酸碱性,故加入足量的BaCl2(其合理也可),生成BaCO3的白色沉淀,该反应的化学方程式为:Na2CO3+BaCl2=BaCO3↓+2NaCl,再检验上层清液呈碱性,故向上层清液中加入无色酚酞,溶液变红;
生成且不能改变溶液的酸碱性,故加入足量的BaCl2(其合理也可),生成BaCO3的白色沉淀,该反应的化学方程式为:Na2CO3+BaCl2=BaCO3↓+2NaCl,再检验上层清液呈碱性,故向上层清液中加入无色酚酞,溶液变红;
【实验反思】 由方案2的结果可知,方案1的结论错误,理由是:Na2CO3溶液也显碱性.
所以答案是:(1)>;
(2)不能;二氧化碳能溶于水,也能使瓶内压强减小;
(3)CO2+Ca(OH)2=CaCO3↓ +H2O;NaOH饱和溶液的浓度大吸收的CO2气体更多;
(4)有气体产生;Ca(OH)2或 Ba(OH)2;
足量的BaCl2(其合理也可);Na2CO3+BaCl2=BaCO3↓+2NaCl;无色酚酞;
Na2CO3溶液也显碱性.