题目内容
实验室存有一定量的溶质质量分数为5%的氢氧化钠溶液,加热蒸发掉108g水后,所得溶液的溶质质量分数变为20%。
求:(1)原氢氧化钠溶液的质量是多少克?
(2)原氢氧化钠溶液中含有溶质多少克?
(1)原氢氧化钠溶液的质量是144克。
(2)原氢氧化钠溶液中含有溶质7.2克。
解析试题分析:(1)设原氢氧化钠溶液质量为x
X × 5% =" (" X ﹣ 108 ) × 20%
X = 144g
(2)原氢氧化钠溶液中溶质质量 =" 144g" ×5% = 7.2g
考点:溶液的计算

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
向一定质量的硫酸铜溶液中加入不同质量的铁粉所呈现的信息如下表:
| Fe质量/g | 5.6 | 11.2 | 16.8 | 22.4[来 |
| Cu质量/g | 6.4 | 12.8 | 19.2 | 22.4 |

取一定量的氧化铁与氧化铜的混合物,加入溶质质量分数为9.8%的稀硫酸100g,恰好完全反应生成盐和水.原混合物中氧元素的质量是( )
| A.6.4g | B.3.2g | C.1.8g | D.1.6g |
把12g某固体放入90g水中充分溶解后过滤,滤出该固体2g,则该滤液的溶质质量分数是
| A.10% | B.11.7% | C.12% | D.13.3% |
工业上以CaO和HNO3为原料制备Ca(NO3)2?6H2O晶体.为确保制备过程中既不补充水,也无多余的水,所用硝酸的溶质质量分数约为( )
| A.41.2% | B.53.8% | C.58.3% | D.70.0% |
(5分)铜镁合金常用作飞机天线等导电材料。欲测定合金的组成(其他元素忽略不计),进行如下实验:取铜镁合金10g放入烧杯,将200g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下。请计算:
| 次 数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸质量/g | 50 | 50 | 50 | 50 |
| 剩余固体质量/g | 8.5 | 7 | 6.6 | 6.6 |
(2)求所加稀硫酸中溶质的质量分数。(写出计算过程)
(7分)某同学做了如下实验: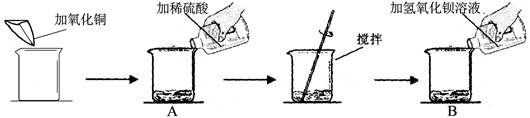
实验数据及部分实验现象如下表:
| | 第一次[来源:学.科.网Z.X.X.K] | 第二次 |
| 加氧化铜的质量(g) | m | m |
| 加稀硫酸的质量(g) | 50 | 100 |
| 加氢氧化钡溶液的质量(g) | 100 | 100 |
| B中主要现象 | 淡蓝色沉淀 | ? |
1、写出第一次试验有溶液颜色改变的化学反应方程式 ;
2、第二次实验B中的主要现象是 ;
3、试验中加入氧化铜m的数值为 ;
4、求解第二次反应中生成固体质量(X)的比例式 ;
5、若将第二次反应后的滤液蒸发32.35克水,则所得不饱和溶液中溶质的质量分数为 ;
6、若用98%的浓硫酸配制试验中所需硫酸,则需要加水的质量为 。