题目内容
【题目】某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)可用于制备FeCO3,其流程如下:

已知:(1)SiO2不溶于水也不溶于一般酸溶液。
(2)“还原”时,FeS2与H2SO4不反应,Fe2(SO4)3通过反应Ⅰ、Ⅱ被还原,反应Ⅰ:7Fe2(SO4)3+FeS2+8H2O=15FeSO4十8H2SO4,反应II:Fe2(SO4)3+FeS2=3FeSO4+2S↓。
回答下列问题:
(1)写出烧渣“酸溶”时发生反应的一个化学方程式________。
(2)第一次过滤所产生的“滤渣”是_____(填化学式),过滤需要的玻璃仪器有__________(任写一种)。
(3)所得FeCO3需充分洗涤,检验是否洗净的方法是___________。第三次过滤所得到的“滤液”中存在的离子有_________(填离子符号)
【答案】![]() 或
或![]() SiO2 玻璃棒(或烧杯、漏斗) 取少许最后一次洗涤液于试管中,滴加稀盐酸,无明显现象(可以没有这一步),再滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净。(其它合理答案也可) NH4+、CO32-、SO42-
SiO2 玻璃棒(或烧杯、漏斗) 取少许最后一次洗涤液于试管中,滴加稀盐酸,无明显现象(可以没有这一步),再滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净。(其它合理答案也可) NH4+、CO32-、SO42-
【解析】
烧渣中主要含Fe2O3、FeO,还有一定量的SiO2,加入过量硫酸,氧化铁和硫酸反应生成硫酸铁和水,氧化亚铁和硫酸反应生成硫酸亚铁和水,过滤,滤渣为二氧化硅,滤液中含有硫酸、硫酸铁和硫酸亚铁,再加入FeS2,硫酸铁被还原为硫酸亚铁,过滤,滤液中只有硫酸亚铁,再加入碳酸铵溶液,硫酸亚铁和碳酸铵反应生成碳酸亚铁沉淀和硫酸铵,过滤,固体为碳酸亚铁,滤液中含有碳酸铵和硫酸铵。
(1)烧渣“酸溶”时,氧化铁和硫酸反应生成硫酸铁和水,氧化亚铁和硫酸反应生成硫酸亚铁和水,化学方程式为:![]() ,
,![]() ;
;
(2)第一次过滤所产生的“滤渣”是二氧化硅,化学式为SiO2;过滤需要的玻璃仪器有烧杯、漏斗、玻璃棒;
(3)所得FeCO3沉淀的表面会有硫酸铵溶液,需充分洗涤,为了检验是否洗净,可以取少许最后一次洗涤液于试管中,滴加稀盐酸,再滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净;
(4)第三次过滤所得到的滤液中含有碳酸铵和硫酸铵,所以存在的离子有NH4+、CO32-、SO42-。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】钙是人体中的常量元素,缺钙时可通过食用保健药剂来增加摄入量。某补钙药剂主要成分为碳酸钙,现将100g盐酸分成5等份,逐次加到用40g该药剂制成的粉末中(其他成分不与盐酸反应),得到部分数据与图象。请根据有关信息回答问题:
序号 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
加入盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
剩余固体的质量/g | 35 | 30 | 25 | 20 | a |
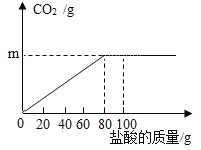
(1)a的数值为___,该品牌补钙药剂中CaCO3的质量分数是___。
(2)求该盐酸中溶质的质量分数____。(写出计算过程,计算结果保留一位小数)
(3)如果在配制该盐酸时质量分数偏小了,对该品牌补钙药剂中CaCO3的质量分数计算是否有影响。你的看法是___。