题目内容
7.O2和CO2总与我们如影随形,下列关于它们的叙述中不正确的是( )| A. | O2具有助燃性,而CO2可用来灭火 | |
| B. | 空气中O2过多无害,而CO2过多会形成酸雨 | |
| C. | 它们都可用向上排空气法收集 | |
| D. | 自然界里它们可通过光合作用和呼吸作用相互转化 |
分析 氧气的化学性质是氧化性和助燃性,氧气的用途是支持燃烧和供给呼吸;二氧化碳的化学性质有:既不能燃烧也不能支持燃烧,也不供给呼吸;能与水反应生成碳酸,但pH不会小于5.6;能使澄清的石灰水变浑浊.氧气和二氧化碳的密度都比空气的密度大,都可用向上排空法收集;二氧化碳是光合作用的原料,氧气是产物,氧气是呼吸作用的原料,二氧化碳是产物.
解答 解:A、氧气能支持燃烧,不能灭火,二氧化碳既不能燃烧也不能支持燃烧,可以灭火,故选项正确;
B、氧气具有氧化性,氧气过多会造成氧化过度,CO2过多不会形成酸雨,会引起温室效应,故选项错误;
C、氧气和二氧化碳的密度都比空气的密度大,都可用向上排空法收集,故选项正确;
D、二氧化碳是光合作用的原料,氧气是产物;氧气是呼吸作用的原料,二氧化碳是产物,故选项正确;
故选B.
点评 本考点考查了二氧化碳和氧气的性质和用途,二氧化碳和氧气与人类生活密切相关,在自然界中实现了碳循环和氧循环.也充分体现了性质决定用途,用途又反映性质的理念.本考点基础性强,主要出现在选择题和实验题中.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.草酸镍晶体(NiC2O4•2H2O)可用于制镍催化剂.某小组用废镍催化剂(成分为Fe2O3、Ni、Fe、SiO2等)制备草酸镍晶体的部分实验流程如图1:
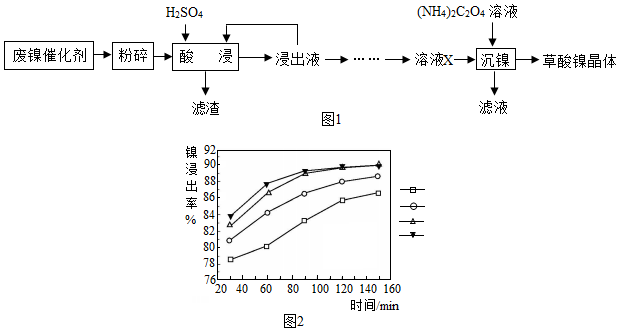
已知:①Ni能和稀H2SO4反应.
②相关金属离子生成氢氧化物沉淀的pH如表
③H2O2能将Fe2+氧化为Fe3+
(1)废镍催化剂“粉碎”的目的是增大与硫酸的接触面积,加快反应速率.
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图2,“酸浸”的适宜温度与时间分别为C(填字母).
A.30℃、30min B.90℃、150min C.70℃、120min D.90℃、120min
(3)“酸浸”中发生的复分解反应方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O.
(4)“浸出液”得到“溶液x”过程中,加入试剂先后顺序是A(填字母)
A.先加H2O2溶液,再加NaOH溶液 B.先加NaOH溶液,再加H2O2溶液
加NaOH溶液调节pH3.2~6.7(填范围),充分反应后得到滤渣的操作是过滤,该操作中所用到的玻璃仪器有玻璃棒、烧杯和漏斗.
(5)将“沉镍”工序:①主要过程为:蒸发浓缩、降温结晶、过滤,所得固体用75%乙醇洗涤、110℃下烘干,得草酸镍晶体.
②用75%乙醇洗涤的目的是洗去杂质、减少草酸镍晶体的损失;
③烘干温度不超过110℃的原因是防止草酸镍失去结晶水.

已知:①Ni能和稀H2SO4反应.
②相关金属离子生成氢氧化物沉淀的pH如表
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Ni2+ | 6.7 | 9.5 |
(1)废镍催化剂“粉碎”的目的是增大与硫酸的接触面积,加快反应速率.
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图2,“酸浸”的适宜温度与时间分别为C(填字母).
A.30℃、30min B.90℃、150min C.70℃、120min D.90℃、120min
(3)“酸浸”中发生的复分解反应方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O.
(4)“浸出液”得到“溶液x”过程中,加入试剂先后顺序是A(填字母)
A.先加H2O2溶液,再加NaOH溶液 B.先加NaOH溶液,再加H2O2溶液
加NaOH溶液调节pH3.2~6.7(填范围),充分反应后得到滤渣的操作是过滤,该操作中所用到的玻璃仪器有玻璃棒、烧杯和漏斗.
(5)将“沉镍”工序:①主要过程为:蒸发浓缩、降温结晶、过滤,所得固体用75%乙醇洗涤、110℃下烘干,得草酸镍晶体.
②用75%乙醇洗涤的目的是洗去杂质、减少草酸镍晶体的损失;
③烘干温度不超过110℃的原因是防止草酸镍失去结晶水.
18.归纳和推理是化学学习的一种重要思维方法,以下类推结果与实际相符合的是( )
| A. | 有机化合物都含有碳元素,含有碳元素的化合物不一定是有机物 | |
| B. | 碳酸盐能与盐酸反应产生气体,能与盐酸反应生成气体的物质一定是碳酸盐 | |
| C. | 铝与盐酸反应生成AlCl3和H2,则金属铁与盐酸反应生成FeCl3和H2 | |
| D. | 酸碱中和反应有水生成,有水生成的反应一定是中和反应 |
15.世界地球日的主题“珍惜地球资源,转换发展方式”下列做法违背该主题的是( )
| A. | 大力开采使用石化燃料 | B. | 利用秸秆垃圾变电 | ||
| C. | 回收利用废旧金属 | D. | 发展太阳能等清洁能源 |
12.生铁是铁和碳的合金,为测定某炼铁厂生产的生铁样品中铁的质量分数,化学兴趣小组的同学称得该生铁样品6.0g,放入烧杯中,向其中加入65.0g稀硫酸,恰好完全反应(Fe+H2SO4═FeSO4+H2↑)(假设杂质不参与反应),测得的实验数据如下:
请你完成有关计算(结果保留一位小数):
(1)硫酸中H:S:O的元素质量比是1:16:24.
(2)反应放出的氢气是0.2g.
(3)生铁样品中铁的质量分数是多少?
(4)反应后所得溶液中溶质的质量分数是多少?
| 反应前 | 反应后 | |
| 烧杯及其中物质的质量 | 97.0g | 96.8g |
(1)硫酸中H:S:O的元素质量比是1:16:24.
(2)反应放出的氢气是0.2g.
(3)生铁样品中铁的质量分数是多少?
(4)反应后所得溶液中溶质的质量分数是多少?
19. 如图是甲、乙、丙三种物质的溶解度曲线.下列有关说法正确的是( )
如图是甲、乙、丙三种物质的溶解度曲线.下列有关说法正确的是( )
 如图是甲、乙、丙三种物质的溶解度曲线.下列有关说法正确的是( )
如图是甲、乙、丙三种物质的溶解度曲线.下列有关说法正确的是( )| A. | 甲、乙、丙三种物质中甲的溶解度最大 | |
| B. | t2℃时,10g水中加10g 甲,充分搅拌可得20g甲溶液 | |
| C. | 其它条件不变,升高温度可使用甲的饱和溶液变成不饱和溶液 | |
| D. | t1℃时甲、乙、丙三者的溶液其溶质质量分数相等 |
 南京盐业质量监督检测站出具的检验报告显示,近期被广泛关注的“脚臭盐”含有毒、有害成分亚硝酸盐.如图是某品牌加碘盐的标签,请回答下列问题:
南京盐业质量监督检测站出具的检验报告显示,近期被广泛关注的“脚臭盐”含有毒、有害成分亚硝酸盐.如图是某品牌加碘盐的标签,请回答下列问题: 蛋白粉是由大豆蛋白、酪蛋白、乳清蛋白或上述几种蛋白混合制成的粉剂,其用途是为营养不良或疾病导致蛋白质缺乏的人群补充营养.请回答:
蛋白粉是由大豆蛋白、酪蛋白、乳清蛋白或上述几种蛋白混合制成的粉剂,其用途是为营养不良或疾病导致蛋白质缺乏的人群补充营养.请回答: