题目内容
9.黄铜是铜、锌合金,外观呈现金黄色,跟金相似.它用于制造机器、电器件等.为测定某黄铜样品中铜的质量.取10克该黄铜样品加入到100g稀盐酸中,恰好完全反应.产生氢气0.2g.试求:(1)该黄铜样品中铜的质量.
(2)稀盐酸中溶质的质量分数.
(3)反应后溶液中溶质的质量分数.
分析 利用氢气的质量结合化学方程式的计算出锌的质量、氯化氢的质量以及氯化锌的质量进行计算即可.
解答 解:设黄铜中锌的质量为x,稀盐酸中溶质的质量为y,生成氯化锌的质量为z
Zn+2HCl=ZnCl2+H2↑
65 73 136 2
x y z 0.2g
$\frac{65}{x}=\frac{73}{y}=\frac{136}{z}=\frac{2}{0.2g}$
x=6.5g y=7.3g z=13.6g
(1)该黄铜样品中铜的质量为:10g-6.5g=3.5g.
(2)稀盐酸中溶质的质量分数为:$\frac{7.3g}{100g}×100%=7.3%$.
(3)反应后溶液中溶质的质量分数为:$\frac{13.6g}{6.5g+100g-0.2g}×100%≈12.8%$
答:(1)该黄铜样品中铜的质量为3.5g.
(2)稀盐酸中溶质的质量分数为7.3%.
(3)反应后溶液中溶质的质量分数为12.8%.
点评 该题难度适中,主要考查了对金属活动性顺序的灵活运用,及根据化学方程式进行有关的计算,培养学生应用知识的能力.

练习册系列答案
相关题目
20.下列各组物质在pH=2的溶液中能大量共存且溶液呈无色的是( )
| A. | KNO3 HCl CuSO4 | B. | Na2SO4 Zn(NO3)2 H2SO4 | ||
| C. | MgCl2 NaOH FeSO4 | D. | Na2CO3 Ba(OH)2 K2SO4 |
14.将酸、碱溶液混合,得到中性溶液,下列说法不正确的是( )
| A. | 酸碱浓度相等 | B. | 原溶液H+数与OH-数相同 | ||
| C. | 酸碱恰好完全反应 | D. | 反应后溶液中水的质量增加 |
2.下列符号只有微观意义,不表示宏观意义的是( )
| A. | Cl2 | B. | 2N2 | C. | Cu | D. | MnO2 |
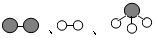 分别表示氮气、氢气和氨气.观察下图,写出符合在催化剂表面合成氨反应过程的正确顺序CEABD(将下面五张图按反应过程顺序用字母序号排列)
分别表示氮气、氢气和氨气.观察下图,写出符合在催化剂表面合成氨反应过程的正确顺序CEABD(将下面五张图按反应过程顺序用字母序号排列)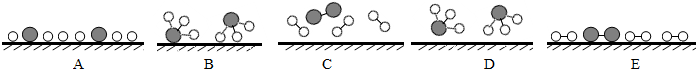
 铁及其化合物是中学化学学习和研究的重要内容.
铁及其化合物是中学化学学习和研究的重要内容.