题目内容
2.取锌、铜的混合物8g与154.7g稀硫酸恰好完全反应,称得剩余物质的总质量为162.5g.请计算:
(1)产生氢气的质量是多少?
(2)混合物中铜的质量是多少?
分析 根据锌、铜的性质可知,加入稀硫酸时,只有锌与硫酸反应生成了硫酸锌和氢气;根据质量守恒定律,烧杯内质量的减少的质量即生成的氢气质量,据此根据反应的化学方程式列式计算出锌的质量,进而计算混合物中铜的质量.
解答 解:(1)产生氢气的质量是 154.7 g+8g-162.5=0.2g.
(2)参加反应的锌的质量为x,
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.2g
$\frac{65}{x}=\frac{2}{0.2g}$
x=6.5g
混合物中铜的质量是8g-6.5g=1.5g
答:(1)产生氢气的质量是0.2g;(2)混合物中铜的质量是1.5g.
点评 本题难度不大,掌握根据化学方程式与溶质质量分数的综合计算即可正确解答本题,根据质量守恒定律计算出氢气的质量是正确解答本题的前提和关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列物质在氧气中燃烧的反应不属于化合反应的是( )
| A. | 红磷 | B. | 木炭 | C. | 铁丝 | D. | 蜡烛 |
18.某学生用托盘天平称量18.5克食盐,向天平添加药品、砝码和游码后(药品和砝码摆放位置正确),发现指针略向右偏,此时该同学应采取的措施是( )
| A. | 将游码向左移动 | B. | 减少砝码 | C. | 加适量的食盐 | D. | 调节平衡螺母 |
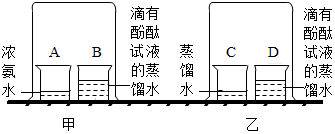 某兴趣小组做如图实验探究分子有运动.请回答实验中的有关问题.
某兴趣小组做如图实验探究分子有运动.请回答实验中的有关问题.