题目内容
9.一定质量的金属铁和稀硫酸恰好完全反应,产生气体的质量为0.2g(1)反应后溶液中溶质FeSO4的质量为15.2g.
(2)向反应后的溶液中加入BaCl2溶液,当加入的BaCl2溶液质量为208g时,恰好完全反应,此时生成沉淀的质量为23.3g.
(3)计算所加BaCl2溶液的溶质质量分数10%.
分析 根据生成的氢气的质量和对应的各个化学方程式找出对应的物质的关系式,利用关系式法求算对应物质,求算对应的质量分数.
解答 解:所发生的反应为:
Fe+H2SO4=FeSO4+H2↑和BaCl2+FeSO4=BaSO4↓+FeCl2得关系式为
FeSO4~~~H2↑~~~BaCl2~~~BaSO4↓
设生成0.2g氢气时,生成的硫酸亚铁的质量为x,消耗的氯化钡的质量为y,生成硫酸钡的质量为z
FeSO4~~~H2↑~~~BaCl2~~~BaSO4↓
152 2 208 233
x 0.2g y z
$\frac{152}{x}$=$\frac{2}{0.2g}$=$\frac{208}{y}$=$\frac{233}{z}$
x=15.2g
y=20.8g
z=23.3g
所加BaCl2溶液的溶质质量分数为$\frac{20.8g}{208g}$×100%=10%
答:(1)反应后溶液中溶质FeSO4的质量为15.2g.
(2)向反应后的溶液中加入BaCl2溶液,当加入的BaCl2溶液质量为208g时,恰好完全反应,此时生成沉淀的质量为23.3g.
(3)所加BaCl2溶液的溶质质量分数10%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

练习册系列答案
相关题目
20.如图所示实验操作,正确的是( )
| A. |  称量固体氢氧化钠 | B. |  测溶液pH | ||
| C. |  过滤 | D. |  稀释浓硫酸 |
4.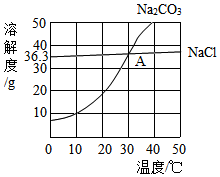 如图为氯化钠、碳酸钠在水中的溶解度曲线,其中氯化钠、碳酸钠两物质的溶解度曲线交点为A.下列说法正确的是( )
如图为氯化钠、碳酸钠在水中的溶解度曲线,其中氯化钠、碳酸钠两物质的溶解度曲线交点为A.下列说法正确的是( )
 如图为氯化钠、碳酸钠在水中的溶解度曲线,其中氯化钠、碳酸钠两物质的溶解度曲线交点为A.下列说法正确的是( )
如图为氯化钠、碳酸钠在水中的溶解度曲线,其中氯化钠、碳酸钠两物质的溶解度曲线交点为A.下列说法正确的是( )| A. | 碳酸钠俗称小苏打 | |
| B. | 30℃时,氯化钠的溶解度为36.3g | |
| C. | 碳酸钠的溶解度大于氯化钠的溶解度 | |
| D. | 将Na2CO3和NaCl均达到饱和的混合溶液,从40℃降温到20℃时,析出的固体物质主要是NaCl |
5.逻辑推理是化学学习常用的思维方法.下列推理正确的是( )
| A. | 酸碱中和反应生成盐和水,实验生成盐和水的反应一定是中和反应 | |
| B. | 酸性溶液的pH小于7,食醋是酸性溶液,所以食醋的pH小于7 | |
| C. | 原子在化学变化中不能再分,则分子在化学变化中也不能再分 | |
| D. | 水能灭火,所以电脑一旦失火应立即用水浇灭 |
12.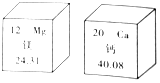 俗话说:“补钙不补镁,补了也后悔”,原来镁有协同钙的作用,会促进钙的吸收.如图是镁、钙在元素周期表中的部分信息,则下列说法不正确的是( )
俗话说:“补钙不补镁,补了也后悔”,原来镁有协同钙的作用,会促进钙的吸收.如图是镁、钙在元素周期表中的部分信息,则下列说法不正确的是( )
 俗话说:“补钙不补镁,补了也后悔”,原来镁有协同钙的作用,会促进钙的吸收.如图是镁、钙在元素周期表中的部分信息,则下列说法不正确的是( )
俗话说:“补钙不补镁,补了也后悔”,原来镁有协同钙的作用,会促进钙的吸收.如图是镁、钙在元素周期表中的部分信息,则下列说法不正确的是( )| A. | 镁和钙都属于金属元素 | B. | 在金属活动性顺序中,镁比钙活泼 | ||
| C. | 镁原子的质子数为12 | D. | 钙的相对原子质量为40.08 |
9.甘氨酸亚铁颗粒是一种最新的补铁制剂,主要成分为甘氨酸亚铁.甘氨酸亚铁(C4H8FeN2O4),是一种浅黄褐色固体粉末,易溶于水,性质稳定.也可促进人体对钙、锌、硒等多种元素的吸收.下列有关说法正确的是( )
| A. | C4H8FeN2O4的相对分子质量为204g | B. | 该物质改善缺铁性贫血 | ||
| C. | 该物质是有机高分子化合物 | D. | 钙、锌、硒都是人体必需的微量元素 |
10.学习化学的目的并不在于人人都要成为化学家,更重要的是学会用化学观点去分析、解决生产生活中的问题.下列说法中,正确的是( )
| A. | 重金属盐能使蛋白质变性起到杀菌作用,因此可用重金属盐溶液浸泡海产品 | |
| B. | 海底蕴藏着大量“可燃冰”,以它为燃料不会对自然界中的碳循环产生影响 | |
| C. | 进入久未开启的地窖,应先做灯火实验 | |
| D. | 夜间发现液化气泄漏应立即开灯检查 |
 如图为A、B、C三种物质的溶解度曲线,试回答:
如图为A、B、C三种物质的溶解度曲线,试回答: