题目内容
16.碳酸钠俗称纯碱、苏打.某工业纯碱中含有一定质量的杂质氯化钠,化学兴趣小组的同学们通过如下实验测定了该纯碱的纯度.称取20g纯碱样品,放入盛有100g稀盐酸的烧杯中,二者恰好完全反应,反应后称得烧杯中溶液的质量为113.4g.请计算:(1)生成二氧化碳气体的质量.
(2)纯碱样品中碳酸钠的质量分数(精确到0.1%).
(3)稀盐酸溶液中溶质的质量分数.
分析 (1)根据化学方程式Na2CO3+2HCl═2NaCl+H2O+CO2↑,可知反应前后减少的质量就是生成二氧化碳的质量;
(2)根据化学方程式和生成二氧化碳的质量可以计算出样品中Na2CO3的质量,进而求出该纯碱样品中Na2CO3的质量分数;
(3)根据化学方程式和生成二氧化碳的质量可以计算出稀盐酸溶液中溶质的质量,进而求质量分数.
解答 解:(1)根据化学方程式Na2CO3+2HCl═2NaCl+H2O+CO2↑,由质量守恒定律可知反应前后减少的质量就是生成二氧化碳的质量,是20g+100g-113.4g=6.6g;
(2)设样品中碳酸钠的质量为x,稀盐酸溶液中溶质的质量为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 44
x y 6.6g
$\frac{106}{44}=\frac{x}{6.6g}$,$\frac{73}{44}=\frac{y}{6.6g}$
x=15.9g,y=10.95g
样品中碳酸钠的质量分数:$\frac{15.9g}{20g}$×100%=79.5%;
(3)稀盐酸溶液中溶质的质量分数:$\frac{10.95g}{100g}×100%$=10.95%.
答:(1)生成二氧化碳的质量是6.6g;
(2)样品中碳酸钠的质量分数为79.5%;
(3)稀盐酸溶液中溶质的质量分数为10.95%.
点评 要想解答好这类题目,要理解和熟记根据化学反应方程式的计算步骤、格式以及与之相关的知识等.

练习册系列答案
相关题目
7. 原子结构模型的建立,经过了几代科学家的艰辛努力,直到现在仍在探索中.其中,行星模型的提出标志着原子结构的现代模型的问世,如图是锂原子结构的行星模型,图中原子核内有3个质子、4个中子.不能根据原子结构的行星模型得出的结论是( )
原子结构模型的建立,经过了几代科学家的艰辛努力,直到现在仍在探索中.其中,行星模型的提出标志着原子结构的现代模型的问世,如图是锂原子结构的行星模型,图中原子核内有3个质子、4个中子.不能根据原子结构的行星模型得出的结论是( )
 原子结构模型的建立,经过了几代科学家的艰辛努力,直到现在仍在探索中.其中,行星模型的提出标志着原子结构的现代模型的问世,如图是锂原子结构的行星模型,图中原子核内有3个质子、4个中子.不能根据原子结构的行星模型得出的结论是( )
原子结构模型的建立,经过了几代科学家的艰辛努力,直到现在仍在探索中.其中,行星模型的提出标志着原子结构的现代模型的问世,如图是锂原子结构的行星模型,图中原子核内有3个质子、4个中子.不能根据原子结构的行星模型得出的结论是( )| A. | 原子始终在做无规则的运动 | |
| B. | 原子核的体积只占整个原子体积的很小部分 | |
| C. | 构成原子核的粒子之间存在一种互相吸引的力 | |
| D. | 原子呈电中性 |
1.如表是几种可燃物在压强为101KPa时间的沸点.请你回答:
(1)X=C2H6;
(2)“祥云”火炬中的燃料含有C3H8,它燃烧的化学方程式是C3H8+5O2$\frac{\underline{\;点燃\;}}{\;}$3CO2+4H2O;
(3)打火机的燃料稍加压即可以液化,减压后(打开开关)液体又容易气化,遇明火即燃烧.上表中可做打火机燃料的是C4H10.
| 可燃物 | CH4 | X | C3H8 | C4H10 | C5H12 |
| 沸点/℃ | -164 | -88.6 | -42.1 | -0.5 | +36.1 |
(2)“祥云”火炬中的燃料含有C3H8,它燃烧的化学方程式是C3H8+5O2$\frac{\underline{\;点燃\;}}{\;}$3CO2+4H2O;
(3)打火机的燃料稍加压即可以液化,减压后(打开开关)液体又容易气化,遇明火即燃烧.上表中可做打火机燃料的是C4H10.
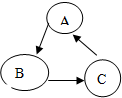 已知A、B、C是初中化学常见的物质,其转化关系如图所示:若A、B、C均含有同一种金属元素,A为红色的金属单质,B是A的氧化物,C为蓝色液体,则:(填化学式)A为Cu,写出一个符合C→A转化关系的化学方程式是:Fe+CuSO4═FeSO4+Cu.此方程的反应类型属于置换反应.
已知A、B、C是初中化学常见的物质,其转化关系如图所示:若A、B、C均含有同一种金属元素,A为红色的金属单质,B是A的氧化物,C为蓝色液体,则:(填化学式)A为Cu,写出一个符合C→A转化关系的化学方程式是:Fe+CuSO4═FeSO4+Cu.此方程的反应类型属于置换反应.