题目内容
 空气主要是由氮气和氧气组成的混合物,请你参与研究性小组有关空气成分测定和性质的实验探究.
空气主要是由氮气和氧气组成的混合物,请你参与研究性小组有关空气成分测定和性质的实验探究.
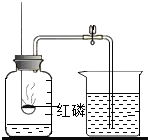
(1)下图是教材中测定空气里氧气含量的实验装置.
填写下表:
| 实验现象 | 结论或解释 |
| 红磷在集气瓶中燃烧 | 反应的化学方程式为:______. |
| 水倒流入集气瓶中,体积 约占集气瓶体积的1/5 | 结论:______. |
A.装置漏气 B.红磷过量
C.温度太高 D.氮气溶解
该小组同学根据空气中氧气含量测定的实验,一致认为:氮气不能支持红磷燃烧.你认为该结论是否正确:______(选填“正确”或“错误”).
(2)该小组的同学对集气瓶中氮气的性质作了进一步的探究.
物理性质探究:
甲同学在实验探究中设计了如右图所示的实验装置.则该同学设计的目的是为了探究氮气的______.
化学性质探究:
乙同学将点燃的镁条迅速伸入集气瓶中,结果发现镁条继续燃烧,并产生黄色固体.据此,你能得出什么结论:______.
丙同学用天平称取2.4g表面处理过的镁条,在一个完全封闭且充满足量空气的容器中完全燃烧,产物冷却后再称量,发现固体质量小于4.0g.原因是:______.
解:(1)红磷燃烧的产物是五氧化二磷,流进集气瓶中的水与集气瓶中中氧气的体积相等;关于误差首先注意误差是小于  ,这样就与药品不能将氧气完全消耗有关,即红磷的量不足或者气密性等方面的问题,所以漏气以及温度未降等原因都可使其不足
,这样就与药品不能将氧气完全消耗有关,即红磷的量不足或者气密性等方面的问题,所以漏气以及温度未降等原因都可使其不足 ,因为红磷有剩余所以可判断氮气不支持燃烧,故该说法正确.
,因为红磷有剩余所以可判断氮气不支持燃烧,故该说法正确.
(2)甲同学把剩余的氮气与水混合是为了检验其是否溶于水,是溶解性的探究;乙同学把镁与氮气混合生成了黄色的氮化镁说明两者能反应.
设2.4g镁条全部生成氧化镁时质量是x
2Mg+O2 2MgO
2MgO
2×24 2×(24+16)
2.4g x

x=4g
由于在空气中一部分镁会与氮气反应生成氮化镁,所以质量会小于4g.
故答案为:(1)4P+5O2 2 P2O5
2 P2O5
氧气约占空气体积的1/5 AC 正确
(2)溶解性 镁能与氮气反应
镁在空气中燃烧时除生成氧化镁外,还有氮化镁生成
分析:(1)红磷燃烧的产物是五氧化二磷,流进集气瓶中的水与集气瓶中中氧气的体积相等;关于误差首先注意误差是小于 ,这样就与药品不能将氧气完全消耗有关,即红磷的量不足或者气密性等方面的问题,因为红磷有剩余所以可判断氮气不支持燃烧.
,这样就与药品不能将氧气完全消耗有关,即红磷的量不足或者气密性等方面的问题,因为红磷有剩余所以可判断氮气不支持燃烧.
(2)甲同学把剩余的氮气与水混合是为了检验其是否溶于水;乙同学把镁与氮气混合生成了新的物质说明两者能反应.2.4g镁条全部生成氧化镁时质量是4g,因为反应时有氮化镁生成所以会小于4g.
点评:完成此类试题要在深入理解实验目的条件下进行,熟悉实验中物质的性质和反应时出现的现象,根据现象得出准确的结论.
 ,这样就与药品不能将氧气完全消耗有关,即红磷的量不足或者气密性等方面的问题,所以漏气以及温度未降等原因都可使其不足
,这样就与药品不能将氧气完全消耗有关,即红磷的量不足或者气密性等方面的问题,所以漏气以及温度未降等原因都可使其不足 ,因为红磷有剩余所以可判断氮气不支持燃烧,故该说法正确.
,因为红磷有剩余所以可判断氮气不支持燃烧,故该说法正确.(2)甲同学把剩余的氮气与水混合是为了检验其是否溶于水,是溶解性的探究;乙同学把镁与氮气混合生成了黄色的氮化镁说明两者能反应.
设2.4g镁条全部生成氧化镁时质量是x
2Mg+O2
 2MgO
2MgO2×24 2×(24+16)
2.4g x

x=4g
由于在空气中一部分镁会与氮气反应生成氮化镁,所以质量会小于4g.
故答案为:(1)4P+5O2
 2 P2O5
2 P2O5氧气约占空气体积的1/5 AC 正确
(2)溶解性 镁能与氮气反应
镁在空气中燃烧时除生成氧化镁外,还有氮化镁生成
分析:(1)红磷燃烧的产物是五氧化二磷,流进集气瓶中的水与集气瓶中中氧气的体积相等;关于误差首先注意误差是小于
 ,这样就与药品不能将氧气完全消耗有关,即红磷的量不足或者气密性等方面的问题,因为红磷有剩余所以可判断氮气不支持燃烧.
,这样就与药品不能将氧气完全消耗有关,即红磷的量不足或者气密性等方面的问题,因为红磷有剩余所以可判断氮气不支持燃烧.(2)甲同学把剩余的氮气与水混合是为了检验其是否溶于水;乙同学把镁与氮气混合生成了新的物质说明两者能反应.2.4g镁条全部生成氧化镁时质量是4g,因为反应时有氮化镁生成所以会小于4g.
点评:完成此类试题要在深入理解实验目的条件下进行,熟悉实验中物质的性质和反应时出现的现象,根据现象得出准确的结论.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
空气是一种宝贵资源.下列有关空气的说法正确的是( )
| A、空气中含量最多的是氧元素 | ||
B、空气主要由氧气和氮气组成,其中氧气约占空气质量的
| ||
| C、空气中的稀有气体化学性质极不活泼,可作焊接金属的保护气 | ||
| D、二氧化碳是污染大气的主要有害气体 |
 人类每时每刻都离不开空气,没有空气就没有生命,也就没有生机勃勃的地球.
人类每时每刻都离不开空气,没有空气就没有生命,也就没有生机勃勃的地球.