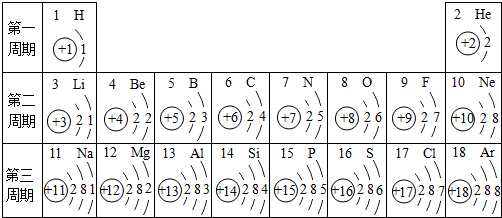
题目内容
20.某固体的样品组成中可能含有铁、硫酸铜、碳酸钙、硫酸钠、氯化钠.为探究其组成,进行如下探究实验;①称取一定质量的样品,加足量水溶解,过滤,得到滤渣和滤液;
②称量滤渣质量为12.32g,向滤渣中滴加10%的稀盐酸至不再产生气体,共消耗稀盐酸73g,收集产生的气体,检验出气体质量为3.56g;
③向滤液中加入足量硝酸钡溶液生成23.3g沉淀
请回答:
(1)产生的气体是氢气和二氧化碳;
(2)经分析,样品中一定含有硫酸铜,原因是根据产生气体为3.56g可计算出滤渣中含铁1.12g和含碳酸钙8g,所以12.32g的滤渣中应该还含有其他固体,只能为铜;
(3)向滤渣中滴加10%的稀盐酸至不再产生气体后所得溶液中一定含有溶质有氯化钙和氯化亚铁;
(4)根据上述条件推断固体样本中一定含有的物质是铁、硫酸铜、碳酸钙、硫酸钠;
(5)写出实验中发生的一条反应方程式Fe+2HCl═FeCl2+H2↑.
(6)如果明确样品质量,你认为能(填“能”或“否”)确定可能含有的物质是否存在.
分析 根据提供的物质结合物质的性质进行分析解答,碳酸钙是不溶于水的物质,铁是不溶于水的物质,铁能与盐酸反应生成氢气,碳酸钙能与盐酸反应生成二氧化碳气体;根据盐酸的用量确定生成的气体的种类;根据加入硝酸钡产生的沉淀的质量确定物质的类别,据此解答.
解答 解:(1)称量滤渣质量为12.32g,向滤渣中滴加10%的稀盐酸至不再产生气体,共消耗稀盐酸73g,收集产生的气体,检验出气体质量为3.56g,铁与盐酸反应生成氯化亚铁和氢气,若是全部生成氢气,设氢气的质量为x,
Fe+2HCl═FeCl2+H2↑
73 2
73g×10% x
$\frac{73}{2}=\frac{73g×10%}{x}$ x=0.2g
碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,设二氧化碳的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
73 44
73g×10% y
$\frac{73}{44}=\frac{73g×10%}{y}$ y=4.4g
现在生成的气体的质量为3.56g,故含有氢气和二氧化碳;
故填:氢气和二氧化碳;
(2)设生成3.56g气体,铁消耗的盐酸的质量为a,生成的氢气的质量为b,
Fe+2HCl═FeCl2+H2↑
73 2
a b
$\frac{73}{2}=\frac{a}{b}$
则碳酸钙消耗的盐酸的质量为7.3g-a,生成的二氧化碳的质量为3.56g-b
CaCO3+2HCl═CaCl2+H2O+CO2↑
73 44
7.3g-a 3.56g-b
$\frac{73}{44}=\frac{7.3g-a}{3.56g-b}$
a=1.46g,故碳酸钙消耗的盐酸的质量为“7.3g-1.46g=5.84g
设铁的质量为x
Fe+2HCl═FeCl2+H2↑
56 73
x 1.46g
$\frac{56}{73}=\frac{x}{1.46g}$ x=1.12g
设碳酸钙的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73
y 5.84g
$\frac{100}{73}=\frac{y}{5.84g}$ y=8g
而滤渣的质量为13.32g,故一定含有铜,铁能与硫酸铜反应生成硫酸亚铁和铜,故一定含有硫酸铜,
故填:根据产生气体为3.56g可计算出滤渣中含铁1.12g和含碳酸钙8g,所以12.32g的滤渣中应该还含有其他固体,只能为铜;
(3)滤渣中含有铁和碳酸钙,能与盐酸反应生成氯化亚铁,碳酸钙能与盐酸反应生成氯化钙,故填:氯化钙和氯化亚铁;
(4)铜的质量为12.32g-1.12g-8g=3.2g,设硫酸铜的质量为x
Fe+CuSO4=FeSO4+Cu
160 64
x 3.2g
$\frac{160}{64}=\frac{x}{3.2g}$ x=8g
8g硫酸铜生成的硫酸钡的质量为y
CuSO4+Ba(NO3)2=Cu(NO3)2+BaSO4↓
160 233
8g y
$\frac{160}{233}=\frac{8g}{y}$ y=11.65g
而加入硝酸钡以后生成的沉淀的是23.3g,故一定含有硫酸钠;
故一定含有的物质是铁、硫酸铜、碳酸钙和硫酸钠,故填:铁、硫酸铜、碳酸钙、硫酸钠;
(5)铁能与盐酸反应生成氯化亚铁和氢气,故填:Fe+2HCl═FeCl2+H2↑;
(6)如果明确样品质量,可以确定氯化钠是否存在,故填:能.
点评 本题为常见的物质成分的推断,解答本题的关键是要掌握物质的性质,本题难度较大,要细心梳理解答.

①称取一定质量的该白色粉末加足量水溶解,得无色溶液A.
②在无色溶液A中加入过量氯化钡溶液,充分反应后过滤,分别得无色溶液B和白色沉淀C;将白色沉淀C洗涤,烘干后称得质量为20g.
③在20g白色沉淀C中加入足量的稀硝酸,沉淀部分消失,并有气泡冒出.
④在无色溶液B中滴加硝酸银溶液和稀硝酸,产生白色沉淀.
由上述实验得出的下列判断中,不正确的是( )
| A. | 白色粉末中一定含有氯化钠 | |
| B. | 无色溶液B中一定含有两种溶质 | |
| C. | 白色粉末中不含碳酸钙、硫酸钠、硫酸铜 | |
| D. | 步骤③生成的气体质量可能是4.4g |
【提出猜想】猜想一:该白色粉末可能是碳酸钙.
猜想二:该白色粉末可能是氢氧化钙;
猜想三:该白色粉末可能是以上两种物质的混合物;
【设计实验】甲同学取该白色粉末装入试管中,加入少量的水,振荡,发现有白色固体不溶解,于是他得出粉末中只有碳酸钙的结论,乙同学认为甲同学的结论不严密,理由是氢氧化钙微溶于水.为了得出较严密的结论,他们继续进行了如下实验,请完成实验报告
| 实验步骤 | 观察到的现象 | 结论 |
| (1)取上述试管中的上层清液,滴加1~2滴无色酚酞试液 | 酚酞溶液不变红 | 碳酸钙 |
| (2)往上述试管内残留的固体中加入稀盐酸 | 由气泡生成 | 白色粉末中含有碳酸钙 |
| A. | 单质 | B. | 元素 | C. | 原子 | D. | 分子 |
| A. | 食物的腐烂 | B. | 塑料的老化 | C. | 酒和醋的酿造 | D. | 燃烧 |
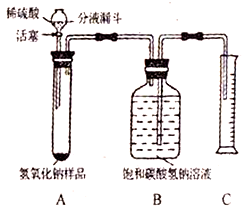 实验室有一瓶长期暴露在空气中已变质的氢氧化钠固体样品,某兴趣小组的同学对该样品的碳酸钠含量进行了探究.
实验室有一瓶长期暴露在空气中已变质的氢氧化钠固体样品,某兴趣小组的同学对该样品的碳酸钠含量进行了探究.