题目内容
某化学兴趣小组,向HCl 和MgCl2的混合溶液中,加入氢氧化钠溶液,过滤,对实验结束后所得“无色滤液”进一步探究.
提出问题:反应后的溶液中含有哪些溶质呢?
猜想与假设:甲同学:溶液中溶质为MgCl2、NaCl,乙同学:溶液中溶质只含有NaOH
表达与交流:甲同学猜想的理由是(1)________.
反思与评价:请对乙同学的猜想做出评价(2)________.
甲同学为了验证自己的猜想,取少量无色滤液于试管中,加入少量的硝酸银溶液,看到白色沉淀,他认为自己猜想是正确的.请对甲同学实验设计做出评价(3)________.
解释与结论:实验证明甲同学的猜想是错误的,则无色滤液中溶质的化学式可能是:(4)________.
归纳与总结:在探究化学反应后溶液中溶质成分时,需要考虑的是(5)________.
解:(1)甲同学猜想的理由是NaOH与HCl和MgCl2反应一定生成NaCl,且MgCl2过量.故填:NaOH与HCl和MgCl2反应一定生成NaCl,且MgCl2过量.
(2)当氢氧化钠溶液过量时,溶液中的溶质中应该含有氢氧化钠和氯化钠,当氢氧化钠恰好和盐酸、氯化镁反应时,溶液中的溶质是氯化钠.故填:乙同学猜想不正确,NaOH与HCl和MgCl2反应生成NaCl,所以溶液中一定存在NaCl.
(3)甲实验不合理,若滤液中有NaCl存在,也会产生上述现象,无法证明MgCl2是否存在.故填:甲实验不合理,若滤液中有NaCl存在,也会产生上述现象,无法证明MgCl2是否存在.
(4)当氢氧化钠过量时,溶液中的溶质是氯化钠和氢氧化钠,当氢氧化钠恰好和盐酸、氯化镁反应时,溶液中的溶质是氯化钠.故填:NaCl或 NaCl、NaOH.
(5)在探究化学反应后溶液中溶质成分时,需要考虑的是反应后生成的可溶性物质和剩余的可溶性的反应物.故填:反应后生成的可溶性物质和剩余的可溶性的反应物.
分析:(1)盐酸和氢氧化钠反应能生成氯化钠和水,氢氧化钠能和氯化镁反应生成氢氧化镁沉淀和氯化钠;
(2)当氢氧化钠溶液过量时,溶液中的溶质中应该含有氢氧化钠和氯化钠;
(3)氯化钠能和硝酸银反应生成氯化银沉淀;
(4)当氢氧化钠过量时,溶液中的溶质是氯化钠和氢氧化钠,当氢氧化钠恰好和盐酸、氯化镁反应时,溶液中的溶质是氯化钠;
(5)在探究化学反应后溶液中溶质成分时,要综合考虑多种因素.
点评:本题主要考查物质之间相互作用时的反应方面的知识,解答时要理解各种物质的性质,只有这样才能对实验现象及其反应情况做出正确的判断.
(2)当氢氧化钠溶液过量时,溶液中的溶质中应该含有氢氧化钠和氯化钠,当氢氧化钠恰好和盐酸、氯化镁反应时,溶液中的溶质是氯化钠.故填:乙同学猜想不正确,NaOH与HCl和MgCl2反应生成NaCl,所以溶液中一定存在NaCl.
(3)甲实验不合理,若滤液中有NaCl存在,也会产生上述现象,无法证明MgCl2是否存在.故填:甲实验不合理,若滤液中有NaCl存在,也会产生上述现象,无法证明MgCl2是否存在.
(4)当氢氧化钠过量时,溶液中的溶质是氯化钠和氢氧化钠,当氢氧化钠恰好和盐酸、氯化镁反应时,溶液中的溶质是氯化钠.故填:NaCl或 NaCl、NaOH.
(5)在探究化学反应后溶液中溶质成分时,需要考虑的是反应后生成的可溶性物质和剩余的可溶性的反应物.故填:反应后生成的可溶性物质和剩余的可溶性的反应物.
分析:(1)盐酸和氢氧化钠反应能生成氯化钠和水,氢氧化钠能和氯化镁反应生成氢氧化镁沉淀和氯化钠;
(2)当氢氧化钠溶液过量时,溶液中的溶质中应该含有氢氧化钠和氯化钠;
(3)氯化钠能和硝酸银反应生成氯化银沉淀;
(4)当氢氧化钠过量时,溶液中的溶质是氯化钠和氢氧化钠,当氢氧化钠恰好和盐酸、氯化镁反应时,溶液中的溶质是氯化钠;
(5)在探究化学反应后溶液中溶质成分时,要综合考虑多种因素.
点评:本题主要考查物质之间相互作用时的反应方面的知识,解答时要理解各种物质的性质,只有这样才能对实验现象及其反应情况做出正确的判断.

练习册系列答案
相关题目
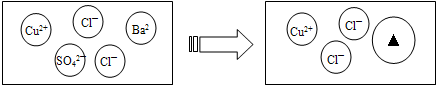
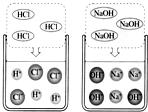 24、某化学兴趣小组利用“稀盐酸、硫酸铜、氢氧化钠、氯化钡”几种物质对复分解反应进行再探究.
24、某化学兴趣小组利用“稀盐酸、硫酸铜、氢氧化钠、氯化钡”几种物质对复分解反应进行再探究.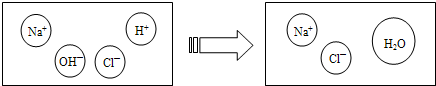


 17、已知M、N分别是稀盐酸、氢氧化钠溶液中的一种.某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH值,如图所示.
17、已知M、N分别是稀盐酸、氢氧化钠溶液中的一种.某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH值,如图所示. 铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关.图1是稀释浓硫酸实验的示意图.
铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关.图1是稀释浓硫酸实验的示意图.