题目内容
14.错误的实验操作,有的会引起误差或导致实验失败,有的会引发安全问题,下列错误的操作有安全隐患的是( )| A. |  测定空气中氧气的含量 | B. |  加热后、闻气体的气味 | ||
| C. | 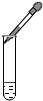 向试管中滴加液体 | D. | 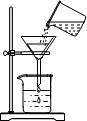 过滤 |
分析 A、木炭燃烧生成二氧化碳,瓶内压强基本保持不变;B、加热液体时,闻气味,容易使液体溅出伤人;C、向试管中滴加液体时要垂悬在试管上方;D、根据过滤操作的注意事项考虑.
解答 解:A、木炭燃烧生成二氧化碳,瓶内压强基本保持不变,进入瓶内水的量减少,不会出现安全问题,故A错;
B、加热液体时,闻气味,容易使液体溅出伤人,有安全隐患,故B正确;
C、向试管中滴加液体时要垂悬在试管上方,不能与试管口接触,否则容易污染试剂,不会产生安全隐患,故C错;
D、过滤操作要用玻璃棒引流,漏斗尖嘴部分紧贴漏斗内壁,不这样操作,会使液体溅出,不会引起安全问题,故D错.
故选B.
点评 化学实验的基本操作是做好化学实验的基础,学生要在平时的练习中多操作,掌握操作要领,使操作规范.

练习册系列答案
相关题目
4.利用化学知识对下列说法进行判断,其中正确的是( )
| A. | 合金、合成橡胶、合成纤维等都是重要的有机合成材料 | |
| B. | 向鸡蛋清中加入饱和硫酸铵溶液出现白色沉淀,该变化是化学变化 | |
| C. | 要提高澄清石灰水的溶质质量分数,可以升高该溶液的温度 | |
| D. | 绿色植物合成葡萄糖的过程是将太阳能转化为化学能 |
5.下列微粒结构示意图中,表示阴离子的是( )
| A. |  | B. |  | C. |  | D. |  |
2. 将有未溶物的试管放入装有水的烧杯中,再向水中倒入浓硫酸,如图所示,则试管中的固体将会( )
将有未溶物的试管放入装有水的烧杯中,再向水中倒入浓硫酸,如图所示,则试管中的固体将会( )
 将有未溶物的试管放入装有水的烧杯中,再向水中倒入浓硫酸,如图所示,则试管中的固体将会( )
将有未溶物的试管放入装有水的烧杯中,再向水中倒入浓硫酸,如图所示,则试管中的固体将会( )| A. | 减少 | B. | 增多 | C. | 不变 | D. | 不能确定 |
6.在测定硫酸铜晶体(CuSO4•xH2O)中结晶水含量的实验中,实验结果x值偏低,若不计称量误差,可能的原因是( )
①加热温度过高、时间过长;②部分晶体风化了;
③在冷却时,CuSO4吸收了水蒸气
④晶体中混有芒硝(主要成分为含水硫酸钠Na2SO4•10H2O)
①加热温度过高、时间过长;②部分晶体风化了;
③在冷却时,CuSO4吸收了水蒸气
④晶体中混有芒硝(主要成分为含水硫酸钠Na2SO4•10H2O)
| A. | ①② | B. | ①②③ | C. | ③④ | D. | ②③ |
14.某化工厂用石灰石和废铜屑等设计生产石青、波尔多液的工艺流程如图:

一、产品制备
(1)流程图中X的化学式为CO2.
(2)反应②分两步进行,化学方程式分别为:
第一步2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,第二步CuO+H2SO4═CuSO4+H2O.
(3)硫酸铜溶液的溶解度如表:
蒸发浓缩后热溶液经处理大量析出晶体,温度到达30℃时,剩余硫酸铜溶液的溶质质量分数为20%;待结晶完毕后,滤出晶体,用少量冰水洗涤2-3次,用冰水洗涤的目的是:Ⅰ是除去晶体表面的杂质;Ⅱ是0℃时硫酸铜溶解度较小,损失少.
(4)反应④中硫酸铜、生石灰和水制备波尔多液,其化学方程式为:
Ⅰ是CaO+H2O═Ca(OH)2;Ⅱ是Ca(OH)2+CuSO4═CaSO4+Cu(OH)2↓.
二、组成测定
查阅资料得知,石青的化学式可表示为aCuCO3•bCu(OH)2,已知Cu(OH)2和CuCO3都能受热分解.分别生成两种氧化物,其中Cu(OH)2的分解温度为66℃到68℃,CuCO3的分解温度为200℃到220℃.为测定其组成,小组同学称取石青样品34.6g,用下图装置进行实验.

(5)洗气瓶A中氢氧化钠溶液的作用是除去空气中的二氧化碳;B中所装液体为浓硫酸.
(6)现控制C装置中的温度为250℃对石青进行热分解,直至C装置中剩余固体质量不再变化为止,再缓缓通入一段时间空气后,冷却后装置D增重1.8g,装置E增重8.8g.通过计算可得a:b=2:1.
(7)若缺少F装置,测得的a:b的值会偏大(选填“偏大”、“偏小”、“不变”).
三、脱水研究
硫酸铜晶体受热会逐步失去结晶水.取纯净CuSO4•5H2O固体2.50g,放在上图实验装置C中进行加热.测定固体质量随温度的变化情况如图所示.
(8)G点固体的化学式是CuSO4•H2O.
(9)H点所得固体的颜色是白色.
(10)将CuSO4•5H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的一种氧化物和水蒸气,该反应的化学方程式为:CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuO+SO3↑+5H2O↑.


一、产品制备
(1)流程图中X的化学式为CO2.
(2)反应②分两步进行,化学方程式分别为:
第一步2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,第二步CuO+H2SO4═CuSO4+H2O.
(3)硫酸铜溶液的溶解度如表:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| 溶解度/g | 14.3 | 17.4 | 20.7 | 25 | 28.5 | 33.3 | 40 | 55 | 75.4 |
(4)反应④中硫酸铜、生石灰和水制备波尔多液,其化学方程式为:
Ⅰ是CaO+H2O═Ca(OH)2;Ⅱ是Ca(OH)2+CuSO4═CaSO4+Cu(OH)2↓.
二、组成测定
查阅资料得知,石青的化学式可表示为aCuCO3•bCu(OH)2,已知Cu(OH)2和CuCO3都能受热分解.分别生成两种氧化物,其中Cu(OH)2的分解温度为66℃到68℃,CuCO3的分解温度为200℃到220℃.为测定其组成,小组同学称取石青样品34.6g,用下图装置进行实验.

(5)洗气瓶A中氢氧化钠溶液的作用是除去空气中的二氧化碳;B中所装液体为浓硫酸.
(6)现控制C装置中的温度为250℃对石青进行热分解,直至C装置中剩余固体质量不再变化为止,再缓缓通入一段时间空气后,冷却后装置D增重1.8g,装置E增重8.8g.通过计算可得a:b=2:1.
(7)若缺少F装置,测得的a:b的值会偏大(选填“偏大”、“偏小”、“不变”).
三、脱水研究
硫酸铜晶体受热会逐步失去结晶水.取纯净CuSO4•5H2O固体2.50g,放在上图实验装置C中进行加热.测定固体质量随温度的变化情况如图所示.
(8)G点固体的化学式是CuSO4•H2O.
(9)H点所得固体的颜色是白色.
(10)将CuSO4•5H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的一种氧化物和水蒸气,该反应的化学方程式为:CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuO+SO3↑+5H2O↑.


