题目内容
碳酸氢钠是一种重要的盐类物质,俗称 ,在生活中用途广泛,试举出碳酸氢钠在生活中的一种用途 .
小江同学设计了以下实验,以探究碳酸氢钠的化学性质.
【探究实验1】碳酸氢钠溶液的酸碱性
【实验方案1】取少量固体于试管中,加入适量水溶解,若用pH试纸测定溶液的pH,正确的方法是 ,测得溶液的pH>7,向溶液中滴加紫色石蕊试液,观察到 ,由此得出结论是 .
【探究实验2】碳酸氢钠的热稳定性
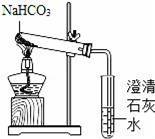
【实验方案2】用如图所示装置进行实验
现象:充分加热后,大试管口有水珠出现,管底有白色固体残留,小试管中澄清石灰水变浑浊.
结论:碳酸氢钠受热能生成二氧化碳、水和一种白色固体.
验证:小江通过实验证明试管中留下的白色固体是Na2CO3,请写出碳酸氢钠受热分解的化学方程式 ;
【继续探究】小江向实验2中完全反应后的试管中加水溶解后,滴入无色酚酞试液,发现溶液变成红色,说明碳酸钠溶液也呈碱性.于是他想通过实验证明碳酸钠溶液也呈碱性是由碳酸根离子引起,而不是由钠离子引起的.现在提供如下试剂:碳酸钠溶液、碳酸钾溶液、氯化钠溶液、氯化钙溶液、酚酞试液,(如果需要你也可以自己选择合适的试剂)请你帮助小江设计实验来证明碳酸钠溶液呈碱性是由CO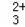
 引起,而不是由Na+引起的,并写出实验步骤、现象和结论.
引起,而不是由Na+引起的,并写出实验步骤、现象和结论.

【考点】实验探究物质的性质或变化规律;常用盐的用途;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
【专题】科学探究.
【分析】根据碳酸氢钠的性质推测其用途;
【实验方案1】用PH试纸检验物质的酸碱度,是较为简便的方法.只需用滴有试液的试纸与标准比色卡对比即可;碱性溶液能使紫色石蕊试液变蓝;
【实验方案2】根据碳酸氢钠受热分解生成了碳酸钠、水和二氧化碳解答;
【继续探究】首先假设钠离子引起溶液呈碱性,那么钠盐溶液都是呈碱性的,但根据所学知识知氯化钠溶液呈中性,说明碱性不是钠离子引起的;那么如果碳酸钠溶液呈碱性的话就一定是碳酸根离子引起的.
【解答】解:
碳酸氢钠是一种重要的盐类物质,俗称小苏打;碳酸氢钠能和酸反应生成二氧化碳,故可以用作治疗胃酸的药物;受热可分解生成二氧化碳,故也可作发酵粉;
【实验方案1】根据pH试纸的使用方法进行分析.测定溶液pH的具体操作方法为:用干净的玻璃棒蘸取待测溶液并滴在pH试纸上,把试纸显示的颜色与标准比色卡对照,读出相同颜色的pH值.测得溶液的pH>7,向溶液中滴加紫色石蕊试液,观察到溶液变蓝;由此得出结论是碳酸氢钠溶液呈碱性;
【实验方案2】碳酸氢钠受热分解生成了碳酸钠、水和二氧化碳,反应的化学方程式 是2NaHCO3
 Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
【继续探究】首先假设钠离子引起溶液呈碱性,那么钠盐溶液都是呈碱性的,但根据所学知识知氯化钠溶液呈中性,说明碱性不是钠离子引起的;那么如果碳酸钠溶液呈碱性的话就一定是碳酸根离子引起的.
所以可以设计两个实验,一是证明氯化钠溶液不显碱性,二是证明碳酸钠溶液呈碱性.可分别加入紫色石蕊试液进行鉴别,若氯化钠溶液不蓝色,碳酸钠溶液变蓝色,则证明呈碱性是碳酸根离子引起的.
取5%NaCl溶液1mL加入试管中,滴加几滴石蕊试液,石蕊试液为紫色(或不变色),Na+不会使溶液显碱性;
取5%Na2CO3溶液1mL加入试管中,滴加几滴石蕊试液,石蕊试液变蓝色,使石蕊试液变蓝色的只能是CO32﹣.
故答案为:
小苏打;治疗胃酸的药物;
【实验方案1】根据pH试纸的使用方法进行分析.测定溶液pH的具体操作方法为:用干净的玻璃棒蘸取待测溶液并滴在pH试纸上,把试纸显示的颜色与标准比色卡对照,读出相同颜色的pH值;溶液变蓝;酸氢钠溶液呈碱性;
【实验方案2】2NaHCO3
 Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
【继续探究】取5%NaCl溶液1mL加入试管中,滴加几滴石蕊试液,石蕊试液为紫色(或不变色),Na+不会使溶液显碱性;
取5%Na2CO3溶液1mL加入试管中,滴加几滴石蕊试液,石蕊试液变蓝色,使石蕊试液变蓝色的只能是CO32﹣.
【点评】掌握碳酸盐和酸反应放出二氧化碳气体,酚酞试液的变色情况、方程式的书写,以及碳酸钠、氢氧化钠的性质,是解答的基础和关键,此外,该题还较好的考查了学生根据题意分析解决问题、应用知识解决问题的能力.

下表是某些农作物生长最适宜的pH范围:
| 农作物 | 茶 | 甜菜 | 小麦 | 大豆 |
| pH | 4.5~5 | 7~7.5 | 6.2~7.5 | 6.5~7.5 |
某地区的土壤呈弱碱性,你认为该地区最不适宜种植的农作物是( )
A.茶 B.甜菜 C.小麦 D.大豆



 .异黄酮中碳元素的质量分数最大
.异黄酮中碳元素的质量分数最大