题目内容
【题目】氯化亚铜(CuCl)广泛应用于冶金、电镀、医药等行业。已知CuCl难溶于水和乙醇,在潮湿空气中易变质。CuCl的制备流程如下:
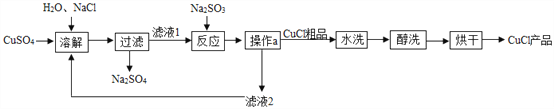
(1)“滤液1”中除了Na+、SO42-外,还存在较多的离子是_______(写离子符号)。
(2)“反应”中发生的化学变化是2CuCl2+2Na2SO3=2CuCl↓+2NaCl+SO3,产生的SO3迅速与水化合生成一种酸,该反应的化学方程式为_______________。
(3)“操作a”的名称是______。“醇洗”的目的是____________。
(4)本流程中可以循环利用的物质(水除外)是_________(写化学式)。
(5)320 g CuSO4与足量NaCl经上述制备流程,可生成的CuCl最多是____________g。
【答案】 Cu2+、Cl- SO3+H2O═H2SO4 过滤 快速除去CuCl固体表面的水分,防止其变质(氧化) NaCl 199
【解析】本题考查了盐的化学性质,过滤的原理,化学方程式的书写,质量守恒定律等。
(1)根据流程图可知,“滤液1”中除了Na+、SO42-外,还存在较多的离子是Cu2+、Cl-;
(2)产生的SO3迅速与水化合生成硫酸,该反应的化学方程式为:SO3+H2O═H2SO4;
(3)“操作a” 把液体和固体分离,“操作a”名称是过滤; “水洗”除去可溶性杂质,得到的固体表面含有水份,CuCl难溶于水和乙醇,在潮湿空气中易变质,“醇洗”的目的快速除去CuCl固体表面的水分,防止其变质(氧化);
(4)“反应”中生成的氯化钠,作为“溶解”中的原料,本流程中可以循环利用的物质(水除外)是NaCl;
(5)320gCuSO4中铜元素质量为:320g×![]() ×100%=128g。硫酸铜中的铜元素全部转化到氯化亚铜中,所以320 g CuSO4与足量足量NaCl经上述制备流程,可生成的CuCl最多是:128g÷(
×100%=128g。硫酸铜中的铜元素全部转化到氯化亚铜中,所以320 g CuSO4与足量足量NaCl经上述制备流程,可生成的CuCl最多是:128g÷(![]() ×100%)=199g。
×100%)=199g。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案