题目内容
2.3g钠,2.4g镁,2.7g铝分别与足量的盐酸反应,按钠、镁、铝的顺序得到的氢气的质量比为
- A.1:2:3
- B.1:1:1
- C.2:3:1
- D.3:2:1
A
分析:根据金属与酸反应的化学方程式进行计算.
解答:设2.3g钠与盐酸反应生成氢气的质量为x
2Na+2HCl═2NaCl+H2↑
46 2
2.3g x
 =
=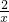
x=0.1g
设2.4g镁与盐酸反应生成氢气的质量为y
Mg+2HCl═MgCl2+H2↑
24 2
2.4g y
 =
=
y=0.2g
设2.7g铝与盐酸反应生成氢气的质量为z
2Al+6HCl═2AlCl3+3H2↑
54 6
2.7g z
 =
=
z=0.3g
所以按钠镁铝的顺序得到的氢气的质量比为0.1g:0.2g:0.3g=1:2:3,观察选项,故选A.
点评:本题考查了常见金属与酸反应生成氢气的质量关系,完成此题,可以依据已有的知识进行.
分析:根据金属与酸反应的化学方程式进行计算.
解答:设2.3g钠与盐酸反应生成氢气的质量为x
2Na+2HCl═2NaCl+H2↑
46 2
2.3g x
 =
=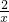
x=0.1g
设2.4g镁与盐酸反应生成氢气的质量为y
Mg+2HCl═MgCl2+H2↑
24 2
2.4g y
 =
=
y=0.2g
设2.7g铝与盐酸反应生成氢气的质量为z
2Al+6HCl═2AlCl3+3H2↑
54 6
2.7g z
 =
=
z=0.3g
所以按钠镁铝的顺序得到的氢气的质量比为0.1g:0.2g:0.3g=1:2:3,观察选项,故选A.
点评:本题考查了常见金属与酸反应生成氢气的质量关系,完成此题,可以依据已有的知识进行.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
2.3g钠,2.4g镁,2.7g铝分别与足量的盐酸反应,按钠、镁、铝的顺序得到的氢气的质量比为( )
| A、1:2:3 | B、1:1:1 | C、2:3:1 | D、3:2:1 |
2.3g
钠、2.4g镁、2.7g铝分别跟足量的盐酸反应,产生氢气的质量比为[ ]
|
A .1∶2∶3 |
B .3∶2∶1 |
C .2∶3∶6 |
D .6∶3∶2 |