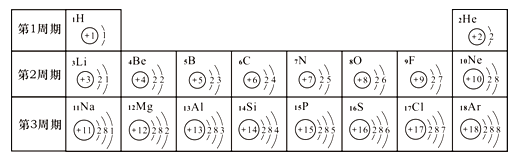
题目内容
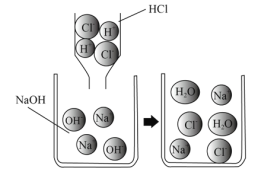
【题目】如图,初中化学中,我们学习了酸和碱发生中和反应的实质是![]() 。像这种用实际参加反应的离子符号来表示反应的式子叫离子方程式。离子方程式的书写一般按以下步骤(以Na2SO4与BaCl2反应为例)
。像这种用实际参加反应的离子符号来表示反应的式子叫离子方程式。离子方程式的书写一般按以下步骤(以Na2SO4与BaCl2反应为例)
①写出反应的化学方程式: ![]() ;
;
②把易溶于水、易电解的物质写出离子形式,把难溶的物质、气体和水等仍用化学式表示。上述方程式可改写成: ![]() ;
;
③删去方程式两边不参加反应的离子:![]() ;
;
④检查方程式两边各元素的原子个数和电荷总数是否相等。
请回答:
(1)下列各组中的离子,能在溶液中大量共存的是(_____)
A K+、H+、SO42-、OH-
B Na+、H+、HCO3-、C1-
C Na+、 Ca2+、NO3-、C1-
D Ca2+、 K+、NO3-、CO32-
(2)写出氢氧化镁和盐酸所发生反应的离子方程式___。
(3)写出一个与离子方程式![]() 中相对应的化学方程式_。
中相对应的化学方程式_。
【答案】C ![]()
![]()
【解析】
(1)A、氢离子和氢氧根离子结合生成水,不能大量共存,故A错误;
B、H+和HCO3-结合生成水和二氧化碳,不能大量共存,故B错误;
C、几种离子不能反应生成气体、沉淀、水,故可以大量共存,故C正确;
D、钙离子和碳酸根离子结合生成碳酸钙,不能大量共存,故D错误。故选C。
(2)氢氧化镁不溶于水,氢氧化镁和盐酸所发生反应的离子方程式为:![]() 。
。
(3)镁与盐酸反应生成氯化镁和氢气,反应的方程式为:![]() ,离子方程式为:
,离子方程式为:![]() 。
。

【题目】回答下列问题。
(1)“侯氏制碱法”制备Na2CO3的流程如下。
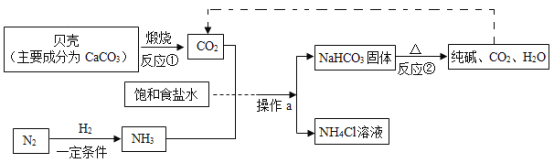
①反应②的化学方程式是___。
②操作a的名称是__,实验室进行此操作所需的主要玻璃仪器有烧杯、玻璃棒和____。
③流程图中能循环利用的物质是_(填化学式) ,副产品为_ ( 填化学式)。
(2)实验室制备纯碱( Na2CO3 )的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30~35°C,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体。
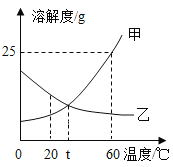
四种盐在不同温度下的溶解度表( g/100g水)
温度 溶解度 | 0°C | 10° C | 20° C | 30° C | 40° C | 50° C | 60°C | 100°C |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | 一 | 一 | 一 | 一 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 16.4 | 一 | |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
①反应温度需要控制在30~ 35°C ,原因是__。为控制此温度,通常采取的加热方法为___。
②保温30分钟,静置后只析出NaHCO3晶体的原因__。