题目内容
实验室里常用锌和稀硫酸反应来制取氢气。林辉同学取6.5g的锌并加入50g一定质量分数的硫酸溶液,恰好完全反应后,得到56.3g硫酸锌溶液。发生反应的化学方程式是:Zn+H2SO4=ZnSO4+H2↑。请你计算:
(1)生成氢气的质量为_____________g。
(2)硫酸溶液中溶质的质量分数。
【答案】
(1)0.2g (2)19.6%
【解析】由锌的质量和稀硫酸的质量根据锌与硫酸反应的化学方程式可以计算出生成氢气的质量和硫酸溶液中溶质的质量分数.
(2)硫酸溶液中溶质的质量分数。
Zn+H2SO4=ZnSO4+H2↑
98 2
X 0.2克
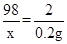
X=9.8克
H2SO4%=9.8克/50克=19.6%

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
