题目内容
13.向盛有12.5g石灰石样品(含有的杂质不溶于水,也不反应)的烧杯中加入50g稀盐酸.一段时间后不再有气体生成,石灰石与盐酸恰好完全反应.生成的气体完全逸出,烧杯中的固体与溶液总质量为58.1g.石灰石中杂质的质量分数为20%.分析 碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳;根据质量守恒定律,烧杯内减少的质量即生成的二氧化碳质量,据此根据反应的化学方程式列式计算出参加反应碳酸钙的质量,进而计算出样品中杂质的质量分数.
解答 解:反应生成二氧化碳的质量为:12.5g+50g-58.1g=4.4g
设样品中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4g
$\frac{100}{x}$=$\frac{44}{4.4g}$
解得:x=10g
所以石灰石中杂质的质量分数为:$\frac{12.5g-10g}{12.5g}$×1005=20%
答:石灰石中杂质的质量分数为20%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律确定生成二氧化碳的质量是正确解答本题的前提和关键.

练习册系列答案
相关题目
10.“低碳生活”倡导我们在生活中所耗用的能量、材料要尽量减少,从而减低二氧化碳的排放量,下列做法不符合“低碳生活”理念的是( )
| A. | 教科书循环使用 | |
| B. | 多使用电子邮箱、微信、QQ等即时通讯工具 | |
| C. | 提倡乘坐公共交通工具,骑自行车或步行等出行方式 | |
| D. | 夏天为了节能,把室内空调温度调低一度 |
11.进行化学实验操作考核时,下列四位同学的操作中正确的是( )
| A. |  称量固体质量 | B. |  溶解固体 | C. |  倾倒液体 | D. |  熄灭酒精灯 |
1.下列有关化合价的说法中,正确的是( )
| A. | 金属元素在化合物中的化合价只能是正价,非金属元素在化合物中的化合价只能是负价 | |
| B. | 氧元素在化合物中一定显-2价,氢元素在化合价中一定显+1价 | |
| C. | 一种元素在同一化合物中只有一种化合价 | |
| D. | 在化合物K2Cr2O7中,Cr元素的化合价为+6价 |
5.下列符号书写正确的是( )
| A. | 氧气--O | |
| B. | 保持水的化学性质的最小粒子是--H2O2 | |
| C. | 钙元素--CA | |
| D. | 一个镁离子--Mg2+ |
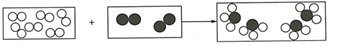
 ”为A2,“
”为A2,“ ”为B2,已知M1(B2)=28,若参加反应的A2质量为9g,生成的产物质量为51g,则M1(生成物)=17.
”为B2,已知M1(B2)=28,若参加反应的A2质量为9g,生成的产物质量为51g,则M1(生成物)=17. 将溶质质量分数为10%的稀盐酸逐滴加入某混合物所在烧杯中.烧杯中的混合物由CaCO3固体和CaCl2固体组成,质量为22.3g.反应情况如图所示:
将溶质质量分数为10%的稀盐酸逐滴加入某混合物所在烧杯中.烧杯中的混合物由CaCO3固体和CaCl2固体组成,质量为22.3g.反应情况如图所示: A、B…H八种物质,有如图所示关系:其中A是紫黑色(暗紫色)固体,E是白色固体,H是黑色固体,在②的反应前后B的质量和化学性质都不改变.试推断:
A、B…H八种物质,有如图所示关系:其中A是紫黑色(暗紫色)固体,E是白色固体,H是黑色固体,在②的反应前后B的质量和化学性质都不改变.试推断: