��Ŀ����
ijʵ��С���ͬѧΪ�˲ⶨʵ�����и��������Ʒ������������ȡ7g����Ʒ�����μ��ȸû����t1��t2��t3��t4ʱ��ֱ���ȴ����ʣ�������������¼���й��������±�����Ʒ�е����ʲ����뻯ѧ��Ӧ��
| ����ʱ�� | t1 | t2 | t3 | t4 |
| ʣ���������/g | 6.88 | 6.55 | 6.36 | 6.36 |
�Լ��㣺
��1������t3ʱ����������Ƿ��Ѿ���ȫ��Ӧ����������ǡ���������������̡���Ԫ�ص�������Ϊ������
��2������ȫ��Ӧ�����������������
��3�������Ʒ�и�����ص���������������ȷ��0.1%��
�����㡿���ݻ�ѧ��Ӧ����ʽ�ļ��㣮
��ר�⡿�йػ�ѧ����ʽ�ļ��㣻�ۺϼ��㣨ͼ���͡������͡��龰�ͼ����⣩��
������������������ȷֽ���������ء��������̺���������Ӧǰ��������Ϊ��Ӱ�ӳ����������������������������Լ�����������������һ�����Լ��������ص�����������
����𡿽⣺��1������t3ʱ���ʣ������������ٱ仯��˵����������Ѿ���ȫ��Ӧ��
����������̡���Ԫ�ص�������Ϊ��55����16��4��=55��64��
�ǣ� 55��64��
��2����Ӧ������������Ϊ��7g��6.36g�T0.64g��
��������0.64g������
��3����KMnO4������Ϊx��
2KMnO4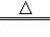
 K2MnO4+MnO2+O2����
K2MnO4+MnO2+O2����
316 32
x 0.64g

 =
=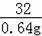
 ��
��
x=6.32g��
KMnO4������������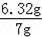
 ��100%=90.3%��
��100%=90.3%��
����Ʒ��KMnO4����������Ϊ90.3%��
���������������ڼ����е�Ӧ�úܹ㷺�����Ĺؼ���Ҫ���������ʵ���������Ҫ���δ֪��֮��Ĺ�ϵ���ٸ��ݾ����������⣮



 SO2
SO2





