题目内容
制取22.4升氧气,需要高锰酸钾的质量是多少?(氧气密度为1.429克/升,计算过程取整数)
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:根据氧气的体积和密度可求出氧气的质量,根据加热分解高锰酸钾的化学方程式,由氧气的质量可求出被分解的高锰酸钾的质量.
解答:解:氧气的质量为:22.4L×1.429g/L≈32g.
设需要分解的高锰酸钾的质量是x.
2KMnO4
K2MnO4+MnO2+O2↑
316 32
x 32g
=
解得:x=316g
答:需分解的高锰酸钾的质量是316g.
设需要分解的高锰酸钾的质量是x.
2KMnO4
| ||
316 32
x 32g
| 316 |
| x |
| 32 |
| 32g |
解得:x=316g
答:需分解的高锰酸钾的质量是316g.
点评:此题是对化学方程式计算的考查题,掌握化学方程式的计算方法和规范性是该题的关键.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
在10℃时,硝酸钾的溶解度为20g,则此温度下的硝酸钾饱和溶液的质量比关系中,正确的是( )
| A、溶质质量:溶剂质量=1:4 |
| B、溶质质量:溶液质量=1:5 |
| C、溶剂质量:溶液质量=5:6 |
| D、溶液质量:溶质质量=4:1 |

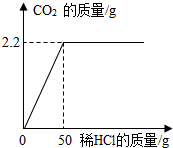 为测定某石灰石样品中碳酸钙的含量,取该石灰石样品10g放入烧杯中,加入一定溶质质量分数的稀盐酸使之充分反应,所加稀盐酸质量与生成的二氧化碳质量关系如图所示.求:
为测定某石灰石样品中碳酸钙的含量,取该石灰石样品10g放入烧杯中,加入一定溶质质量分数的稀盐酸使之充分反应,所加稀盐酸质量与生成的二氧化碳质量关系如图所示.求: