题目内容
某校课外活动小组的同学们利用水的电解实验探究水的组成,他们量取192.7mL水(水的密度为1.00g/cm3),并向水中加入了7.3g氢氧化钠固体,充分溶解后按下图所示的装置进行实验,接通电源,当A管收集到22.3mL气体(气体密度为0.09g/L)时,停止实验。请分析回答:

(1)水通电分解的化学反应方程式为:
(2)实验中A管生成的气体质量是 ;
(3)向水中加入氢氧化钠固体的目的是
;
(4)停止实验时剩余“水中”氢氧化钠的质量分数是多少?(列式计算)
【答案】
(1)2H 2O 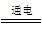 2H2↑+O2↑?
2H2↑+O2↑?
(2)22.3mL×0.09g/L×10-3=0.002g?
(3)增强“水”的导电性?
(4) 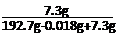 ×100%=3.65%
(2分)
×100%=3.65%
(2分)
【解析】(1)电解水的化学方程式为2H 2O 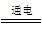 2H2↑+O2↑;(2)m=ρV=22.3mL×0.09g/L×10-3=0.002g; (3)纯净的水是不导电的,加入NaOH固体目的就是增强“水”的导电性;(4)电解产生0.002gH2需要水的质量为 0.002g ×9=0.018g,则反应后溶液的质量=192.7mL×1.00g/cm3+7.3g-0.018g=199.982g,则NaOH的质量分数为
2H2↑+O2↑;(2)m=ρV=22.3mL×0.09g/L×10-3=0.002g; (3)纯净的水是不导电的,加入NaOH固体目的就是增强“水”的导电性;(4)电解产生0.002gH2需要水的质量为 0.002g ×9=0.018g,则反应后溶液的质量=192.7mL×1.00g/cm3+7.3g-0.018g=199.982g,则NaOH的质量分数为
7.3g/199.982g×100%=3.65% 。

练习册系列答案
相关题目
某校课外活动小组的同学欲测定某无色溶液中是否含SO42-,甲、乙两组同学分别是设计了Ⅰ、Ⅱ两个方案如下表:
为了避免犯上面两组同学相同的错误,请你设计一个实验,能确切的证明该溶液中含有SO42-,要求写明实验操作步骤、现象及结论.
| 方案 | 实验方法和步骤 | 实验现象 | 实验结论 | 老师评价 |
| Ⅰ | (1)无色溶液中加BaCl2;(2)白色沉淀中加稀HNO3 | 产生白色沉淀;沉淀不溶解 | 存在SO42- | 不合理 |
| Ⅱ | (1)无色溶液中加Ba(NO3)2;(2)白色沉淀中加稀H2SO4 | 产生白色沉淀;仍有大量白色沉淀 | 存在SO42- | 不合理 |
| 你认为 | 方案Ⅰ不合理的理由是,若溶液中有 同样有上述现象. | |||
| 方案Ⅱ不合理的理由是,若溶液中有 同样有上述现象. | ||||
 (2012?济宁)我市东部山区盛产石灰石,某校课外活动小组为了解石灰石资源的品质,采用两种方案对当地石材进行化学分析:
(2012?济宁)我市东部山区盛产石灰石,某校课外活动小组为了解石灰石资源的品质,采用两种方案对当地石材进行化学分析: 石灰石,某校课外活动小组为了解石灰石资源的品质,采用两种方案对当地石材进行化学分析:
石灰石,某校课外活动小组为了解石灰石资源的品质,采用两种方案对当地石材进行化学分析: