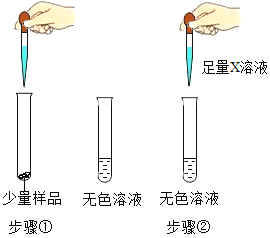
题目内容
【题目】废干电池内的黑色固体含有MnO2、ZnCl2、NH4Cl、C(少量)等物质。化学小组欲通过以下流程,分离并回收部分物质。回答相关问题;
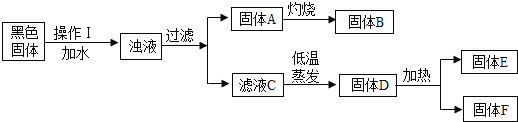
(1)玻璃棒在操作I中的作用:____________________。
(2)过滤后,滤液C仍然浑浊,则造成浑浊的原因可能是_______(填编号)。
A 滤纸破损
B 过滤过程中滤液的液面超过了滤纸的边缘
C 烧杯不干净
D 滤波C中的物质相互反应
(3)固体B常用作催化剂,则B是___(填化学式),写出在空气中灼烧A时发生反应的化学方程式:__。
(4)仅用硝酸银溶液___(填“能”或“不能”)区分E和F。某同学认为固体E是NH4Cl,则检验方法是:____。
(5)NH4Cl属于化学肥料中的_________肥。
【答案】搅拌,加快溶解速度 ABC MnO2 C+O2![]() CO2 不能 取少量E加入适量熟石灰(或其他强碱),并加热,若闻到刺激性气味的气体,则E为NH4Cl 氮
CO2 不能 取少量E加入适量熟石灰(或其他强碱),并加热,若闻到刺激性气味的气体,则E为NH4Cl 氮
【解析】
(1)操作I加水溶解,玻璃棒在操作I中的作用:搅拌,加快溶解速度。
(2)过滤后,滤液C仍然浑浊,则造成浑浊的原因可能是: 滤纸破损,滤液没有经过滤纸过滤就流入烧杯;过滤过程中滤液的液面超过了滤纸的边缘,滤液没有经过滤纸过滤就流入烧杯;烧杯不干净,含有杂质导致滤液浑浊。故选ABC。
(3)固体A中含有不溶性碳和二氧化锰,碳具有可燃性,充分燃烧生成二氧化碳气体,二氧化锰不能燃烧,经过灼烧处理,即可得到固体B,则B是纯净的MnO2,常用作催化剂;在空气中灼烧A时发生反应的化学方程式:C+O2![]() CO2。
CO2。
(4)仅用硝酸银溶液不能区分E和F,因为氯化锌和氯化铵都会和硝酸银反应生成氯化银白色沉淀,现象相同。某同学认为固体E是NH4Cl,根据铵根离子检验氯化铵,则检验方法是:取少量E加入适量熟石灰(或其他强碱),并加热,若闻到刺激性气味的气体,则E为NH4Cl。
(5)NH4Cl中含有氮、磷、钾元素中的氮元素,属于化学肥料中的氮肥。

【题目】实验室中有一瓶长期使用的氢氧化钠固体样品,某兴趣小组的同学对该样品的成分及含量进行探究
[发现问题]该样品中含有哪些物质?
[查阅资料]①NaOH在空气中不会转化成NaHCO3②BaCl2溶液呈中性,Ba(OH)2是可溶性碱③CO2在饱和的NaHCO3溶液中几乎不溶解
[提出猜想]猜想Ⅰ:NaOH
猜想Ⅱ:Na2CO3
猜想Ⅲ:NaOH和Na2CO3
[设计实验]
实验操作 | 实验现象 |
| 步骤(1):样品全部溶解 步骤(2):观察到现象A |
[收集证据](1)若现象A是有气泡产生,则x为_______溶液 (填化学式),则_______(填“猜想Ⅰ”、“猜想Ⅱ” 或“猜想Ⅲ”)不成立。
(2)若X溶液为Ba(OH)2溶液,现象A是有白色沉淀生成,则产生沉淀的化学方程式是______。取反应后的上层清液,测定其pH>7,则证明猜想Ⅲ成立,这个结论是否正确_______(填“是”或“否”)。
[定量分析]确定部分变质样品中Na2CO3的质量分数,兴趣小组的同学用如图所示装置进行实验。
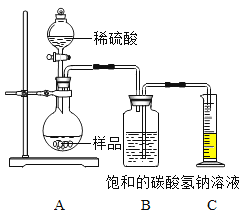
步骤如下:①按图连接好装置,井检查气密性:②准确称取该样品1.0g放入烧瓶内;③打开活塞,滴加30.0%的稀硫酸至过量,关闭活塞;④反应结束后,量筒内液体的读数为55.0mL.(已知:室温条件下,CO2的密度为1.6g﹒L-1 )
(1)B装置集气瓶内原有的空气对实验结果_______(填 “有”或“没有”)影响。B中饱和NaHCO3溶液如果用水代替,则所测CO2体积______(填 “偏大”、“偏小”或“不变”)。
(2)通过计算,便可测得该样品中Na2CO3的质量分数。______