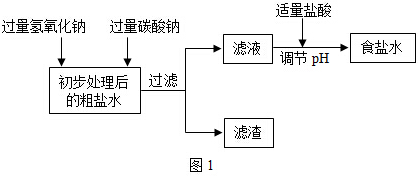
题目内容
5.下图所示的实验操作错误的是( )| A. |  检查气密性 | B. |  制取气体 | C. |  检验氧气 | D. |  取用固体粉末 |
分析 A、根据检查装置气密性的方法进行分析判断.
B、使用长颈漏斗时,长颈漏斗的末端应伸入液面以下,据此进行分析判断.
C、根据氧气的验满方法进行分析判断.
D、根据向试管中粉末状固体药品的方法进行分析判断.
解答 解:A、检查装置气密性的方法:把导管的一端浸没在水里,双手紧贴容器外壁,若导管口有气泡冒出,装置不漏气;图中所示操作正确.
B、使用长颈漏斗时,长颈漏斗的末端应伸入液面以下,图中长颈漏斗的末端应没有伸入液面以下,产生的气体易从长颈漏斗中逸出,图中所示操作错误.
C、检验氧气的验满方法:应将带火星的木条放在集气瓶口,不能伸入瓶中,图中所示操作错误.
D、取用粉末状药品,试管横放,用药匙或纸槽把药品送到试管底部,图中所示操作正确.
故选:BC.
点评 本题难度不大,熟悉各种仪器的用途及使用注意事项、常见化学实验基本操作的注意事项是解答此类试题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15. 向盛有某液体的烧杯中逐滴加入x溶液至过量(如图1),生成沉淀或气体的质量与加入x溶液的质量关系符合图2的是( )
向盛有某液体的烧杯中逐滴加入x溶液至过量(如图1),生成沉淀或气体的质量与加入x溶液的质量关系符合图2的是( )
 向盛有某液体的烧杯中逐滴加入x溶液至过量(如图1),生成沉淀或气体的质量与加入x溶液的质量关系符合图2的是( )
向盛有某液体的烧杯中逐滴加入x溶液至过量(如图1),生成沉淀或气体的质量与加入x溶液的质量关系符合图2的是( )| 烧杯中的物质 | x溶液 | |
| A | 镁铝合金 | 稀盐酸 |
| B | NaHCO3和NaCl溶液 | 稀盐酸 |
| C | H2SO4和CuSO4溶液 | NaOH溶液 |
| D | 稀盐酸和稀硫酸 | Na2CO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
16.“阳羡雪芽”是一种绿茶,绿茶中含有单宁酸(化学式为C76H52O46)具有抑制血压上升﹑清热解毒等功效.下列关于单宁酸的说法正确的是( )
| A. | 单宁酸中氧元素的质量分数最小 | |
| B. | 单宁酸由碳﹑氢和氧三种元素组成 | |
| C. | 单宁酸的相对分子质量为1700g | |
| D. | 单宁酸中碳﹑氧两种元素的质量之比为76:46 |
14.某反应的微观示意图如图,有关说法正确的是( )
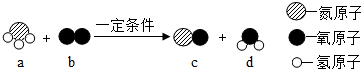

| A. | 该反应属于化合反应 | B. | 氧原子的结构示意图为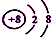 | ||
| C. | b,d两种物质均由分子组成 | D. | a物质中氮元素的化合价为+3价 |