题目内容
测得某CO与CO2的混合气体中,氧元素的质量分数为64%,将该混合气体10g通过足量灼热的氧化铁后,再通入足量的澄清石灰水中,最多可得白色沉淀
- A.28g
- B.40g
- C.30g
- D.50g
C
分析:由题意“测得某CO与CO2的混合气体中,氧元素的质量分数为64%”,而碳元素的质量分数为1-64%=36%,则可求该混合气体10g中的碳元素的质量;根据质量守恒定律的元素守恒,“将该混合气体10g通过足量灼热的氧化铁后”,碳元素都会转化为二氧化碳中,故可求二氧化碳的质量,则根据二氧化碳与氢氧化钙溶液反应的化学方程式,可求碳酸钙的质量.
解答:由题意“测得某CO与CO2的混合气体中,氧元素的质量分数为64%”,而碳元素的质量分数为1-64%=36%,则:
10g×36%=3.6g;根据质量守恒定律的元素守恒,“将该混合气体10g通过足量灼热的氧化铁后”,碳元素都会转化为二氧化碳中,故可求二氧化碳的质量:3.6÷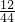 ×100%=13.2g.
×100%=13.2g.
设所得二氧化碳通入足量的澄清石灰水中,最多可得白色沉淀的质量为x.
Ca(OH)2+CO2=H2O+CaCO3↓
44 100
13.2g x

解得x=30g.
故选C.
点评:本题是运用化学中的基本思想质量守恒思想,通过归纳不同物质或不同变化过程中相同点和不同点有效地寻找出它们之间的内在联系以及融合点和嫁接点,从而培养了学生的创新思维能力.
分析:由题意“测得某CO与CO2的混合气体中,氧元素的质量分数为64%”,而碳元素的质量分数为1-64%=36%,则可求该混合气体10g中的碳元素的质量;根据质量守恒定律的元素守恒,“将该混合气体10g通过足量灼热的氧化铁后”,碳元素都会转化为二氧化碳中,故可求二氧化碳的质量,则根据二氧化碳与氢氧化钙溶液反应的化学方程式,可求碳酸钙的质量.
解答:由题意“测得某CO与CO2的混合气体中,氧元素的质量分数为64%”,而碳元素的质量分数为1-64%=36%,则:
10g×36%=3.6g;根据质量守恒定律的元素守恒,“将该混合气体10g通过足量灼热的氧化铁后”,碳元素都会转化为二氧化碳中,故可求二氧化碳的质量:3.6÷
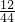 ×100%=13.2g.
×100%=13.2g.设所得二氧化碳通入足量的澄清石灰水中,最多可得白色沉淀的质量为x.
Ca(OH)2+CO2=H2O+CaCO3↓
44 100
13.2g x

解得x=30g.
故选C.
点评:本题是运用化学中的基本思想质量守恒思想,通过归纳不同物质或不同变化过程中相同点和不同点有效地寻找出它们之间的内在联系以及融合点和嫁接点,从而培养了学生的创新思维能力.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
测得某CO与CO2的混合气体中,氧元素的质量分数为64%,将该混合气体10g通过足量灼热的氧化铁后,再通入足量的澄清石灰水中,最多可得白色沉淀( )
| A、28g | B、40g | C、30g | D、50g |