题目内容
广东省拥有丰富的海洋资源,推进建设海洋强省的蓝色经济发展战略,需要综合利用与科学开发宝贵的海洋资源.则回答下列问题:
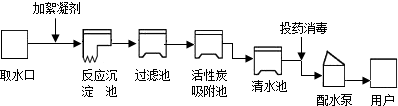
(1)目前世界上60%的镁是从海水中提取的.其主要步骤如图:

①提取Mg的过程中,试剂A可以选用 ,试剂B选用 ,由无水MgCl2制取Mg的反应时基本类型为 .
②分离出Mg(OH)2后的NaCl溶液中还含有CaCl2、Na2SO4等杂质,为了获得NaCl溶液,在分离后的溶液中依次加入过量的BaCl2溶液、Na2CO3溶液,过滤,再向滤液中加入适量盐酸.实验中加入过量BaCl2溶液是为了除去 ;加入过量Na2CO3溶液的目的是 .
(2)从海水中提取食盐.则回答:
①制备粗盐:利用风吹日晒可以从海水中提取粗盐,风吹日晒的主要作用是 ;
②粗盐纯化:氯化钠溶解过程中搅拌的目的是 ;
③精盐利用:工业上利用氯化钠饱和溶液在通电条件下生成烧碱、氢气和氯气,请写出相关的化学方程式为 .
(1)目前世界上60%的镁是从海水中提取的.其主要步骤如图:

①提取Mg的过程中,试剂A可以选用
②分离出Mg(OH)2后的NaCl溶液中还含有CaCl2、Na2SO4等杂质,为了获得NaCl溶液,在分离后的溶液中依次加入过量的BaCl2溶液、Na2CO3溶液,过滤,再向滤液中加入适量盐酸.实验中加入过量BaCl2溶液是为了除去
(2)从海水中提取食盐.则回答:
①制备粗盐:利用风吹日晒可以从海水中提取粗盐,风吹日晒的主要作用是
②粗盐纯化:氯化钠溶解过程中搅拌的目的是
③精盐利用:工业上利用氯化钠饱和溶液在通电条件下生成烧碱、氢气和氯气,请写出相关的化学方程式为
考点:对海洋资源的合理开发与利用,结晶的原理、方法及其应用,盐的化学性质,书写化学方程式、文字表达式、电离方程式
专题:常见的盐 化学肥料
分析:(1)①氢氧化钙能和硫酸镁反应生成氢氧化镁沉淀,稀盐酸能和氢氧化镁反应生成氯化镁和水,电解熔融的氯化镁能生成镁和氯气;
②氯化钡能和硫酸钠反应生成硫酸钡沉淀和氯化钠,碳酸钠能和氯化钙反应生成碳酸钙沉淀和氯化钠以及碳酸钠和氯化钡反应生成碳酸钡和氯化钠.
(2)①根据制盐原理进行分析;
②根据搅拌的作用进行分析;
③根据物质的反应和质量守恒定律分析;
②氯化钡能和硫酸钠反应生成硫酸钡沉淀和氯化钠,碳酸钠能和氯化钙反应生成碳酸钙沉淀和氯化钠以及碳酸钠和氯化钡反应生成碳酸钡和氯化钠.
(2)①根据制盐原理进行分析;
②根据搅拌的作用进行分析;
③根据物质的反应和质量守恒定律分析;
解答:解:(1)①提取Mg的过程中,试剂A可以选用氢氧化钠或氢氧化钙溶液,试剂B选用稀盐酸;氯化镁分解能生成氯气和镁,属于分解反应.故填:氢氧化钠溶液;稀盐酸;分解反应.
②要除去氯化钠中的CaCl2、Na2SO4等杂质,可以首先加入氯化钡溶液除去硫酸钠,加入的碳酸钠溶液能与氯化钙溶液反应生成碳酸钙沉淀,能与上一步中多加的氯化钡反应生成碳酸钡沉淀,所以实验中加入过量BaCl2溶液是为了除去硫酸钠;加入过量Na2CO3溶液的目的是除去CaCl2和BaCl2.故填:Na2SO4;除去CaCl2和BaCl2.
(2)①在制备粗盐时利用风吹日晒是让水份蒸发,减少溶剂的量;
②氯化钠溶解过程中搅拌的目的是加速氯化钠的溶解;
③氯化钠饱和溶液在通电条件下生成烧碱、氢气和氯气,其化学方程式为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
故答案为:(1)①氢氧化钠溶液; 稀盐酸; 分解反应; ②Na2SO4;除去CaCl2和BaCl2;(2)①蒸发水分; ②加速溶解;③2NaCl+2H2O
2NaOH+H2↑+Cl2↑
②要除去氯化钠中的CaCl2、Na2SO4等杂质,可以首先加入氯化钡溶液除去硫酸钠,加入的碳酸钠溶液能与氯化钙溶液反应生成碳酸钙沉淀,能与上一步中多加的氯化钡反应生成碳酸钡沉淀,所以实验中加入过量BaCl2溶液是为了除去硫酸钠;加入过量Na2CO3溶液的目的是除去CaCl2和BaCl2.故填:Na2SO4;除去CaCl2和BaCl2.
(2)①在制备粗盐时利用风吹日晒是让水份蒸发,减少溶剂的量;
②氯化钠溶解过程中搅拌的目的是加速氯化钠的溶解;
③氯化钠饱和溶液在通电条件下生成烧碱、氢气和氯气,其化学方程式为:2NaCl+2H2O
| ||
故答案为:(1)①氢氧化钠溶液; 稀盐酸; 分解反应; ②Na2SO4;除去CaCl2和BaCl2;(2)①蒸发水分; ②加速溶解;③2NaCl+2H2O
| ||
点评:本题主要考查海水中提取镁和食盐的知识,解答时应该充分理解物质之间相互作用反应的情况.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关实验现象的描述中,正确的是( )
| A、红磷在空气中燃烧,产生大量白色烟雾 |
| B、木炭在氧气中剧烈燃烧,放出白光,生成二氧化碳气体 |
| C、镁条在空气中燃烧,产生耀眼强光,生成白色固体 |
| D、硫在空气中剧烈燃烧,产生明亮的蓝紫色火焰 |
教育部2014年1月29日发布校园全面禁烟.一个烟头可能引起一场火灾,防火从细心做起,烟头在火灾发生中的“罪状”是( )
| A、使可燃物温度达到着火点 |
| B、提供可燃物 |
| C、提供氧气 |
| D、降低可燃物的着火点 |
 某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如图装置.倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(氢气的密度为由上述实验事实可知:
某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如图装置.倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(氢气的密度为由上述实验事实可知: