题目内容
测知含一种杂质的Fe2O3粉末中含氧32.5%,则这种杂质不可能是
- A.MgO
- B.Fe(OH)3
- C.FeO
- D.Al2O3
C
分析:假定该物质为纯净物,求出Fe2O3中氧元素的质量分数,与题给数据为是氧化铁中氧元素的质量分数与杂质中氧元素的质量分数(不含氧元素的质量分数为0)平均值,做比较.根据物质中某元素的质量分数= ×100%,进行解答本题.
×100%,进行解答本题.
解答:纯净的Fe2O3氧元素的质量分数为: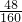 ×100%=30%,题目给的数据为是氧化铁中氧元素的质量分数与杂质中氧元素的质量分数(不含氧元素的质量分数为0)平均值,由于32﹒5%>30%,则杂质中必须含有氧元素,且氧元素的质量分数必须要大于32﹒5%.
×100%=30%,题目给的数据为是氧化铁中氧元素的质量分数与杂质中氧元素的质量分数(不含氧元素的质量分数为0)平均值,由于32﹒5%>30%,则杂质中必须含有氧元素,且氧元素的质量分数必须要大于32﹒5%.
A、MgO中氧元素的质量分数= =40%,故A正确;
=40%,故A正确;
B、Fe(OH)3中氧元素的质量分数= =44.9%,故B正确;
=44.9%,故B正确;
C、FeO中氧元素的质量分数= =22.2%,故C错误;
=22.2%,故C错误;
D、Al2O3中氧元素的质量分数= =47%,故D正确.
=47%,故D正确.
故选:C.
点评:混合物成分的确定用极值法,也就是先假定该物质为纯净物,算出相关的量,再与题给量相比较,就能得出正确的结论.
分析:假定该物质为纯净物,求出Fe2O3中氧元素的质量分数,与题给数据为是氧化铁中氧元素的质量分数与杂质中氧元素的质量分数(不含氧元素的质量分数为0)平均值,做比较.根据物质中某元素的质量分数=
 ×100%,进行解答本题.
×100%,进行解答本题.解答:纯净的Fe2O3氧元素的质量分数为:
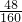 ×100%=30%,题目给的数据为是氧化铁中氧元素的质量分数与杂质中氧元素的质量分数(不含氧元素的质量分数为0)平均值,由于32﹒5%>30%,则杂质中必须含有氧元素,且氧元素的质量分数必须要大于32﹒5%.
×100%=30%,题目给的数据为是氧化铁中氧元素的质量分数与杂质中氧元素的质量分数(不含氧元素的质量分数为0)平均值,由于32﹒5%>30%,则杂质中必须含有氧元素,且氧元素的质量分数必须要大于32﹒5%.A、MgO中氧元素的质量分数=
 =40%,故A正确;
=40%,故A正确;B、Fe(OH)3中氧元素的质量分数=
 =44.9%,故B正确;
=44.9%,故B正确;C、FeO中氧元素的质量分数=
 =22.2%,故C错误;
=22.2%,故C错误;D、Al2O3中氧元素的质量分数=
 =47%,故D正确.
=47%,故D正确.故选:C.
点评:混合物成分的确定用极值法,也就是先假定该物质为纯净物,算出相关的量,再与题给量相比较,就能得出正确的结论.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
测知含一种杂质的Fe2O3粉末中含氧32.5%,则这种杂质不可能是( )
| A、MgO | B、Fe(OH)3 | C、FeO | D、Al2O3 |