题目内容
 现有10g石灰石样品与稀盐酸反应制取二氧化碳气体,反应产生的二氧化碳气体的质量与加入的稀盐酸的质量关系如图所示(提示:石灰石样品中的杂质不溶于水,也不发生反应).
现有10g石灰石样品与稀盐酸反应制取二氧化碳气体,反应产生的二氧化碳气体的质量与加入的稀盐酸的质量关系如图所示(提示:石灰石样品中的杂质不溶于水,也不发生反应).
(1)该石灰石样品中碳酸钙的质量分数是多少?
(2)所用稀盐酸的溶质质量分数是多少?
(3)当石灰石样品恰好完全反应时,若将此时的反应容器内物质进行过滤,所得溶液的质量是多少?
解:(1)设碳酸钙的质量为x,参加反应的盐酸的质量为y,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 111 44
x y 2.2g
 ,x=5g
,x=5g
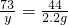 ,y=3.65g
,y=3.65g
该石灰石样品中碳酸钙的质量分数= ×100%=50%
×100%=50%
(2)参加反应的盐酸的质量为= ×100%=10%
×100%=10%
(3)36.5g+10gg-2.2g-(10g-5g)=39.3g
答:(1)石灰石样品中碳酸钙的质量分数为50%;(2)所用稀盐酸的溶质质量分数为10%
(3)所得溶液的质量为39.3g
分析:(1)根据二氧化碳的质量可求出碳酸钙的质量,最后根据 ×100%可求出石灰石样品中碳酸钙的质量分数.
×100%可求出石灰石样品中碳酸钙的质量分数.
(2)根据二氧化碳的质量可求出盐酸的质量,再求所用稀盐酸的溶质质量分数;
(3)据图可看出石灰石样品恰好完全反应时所加稀盐酸的质量为36.5g,所得溶液的质量=所加入的所有物质的质量总和-生成气体的质量-沉淀的质量.
点评:求反应后所得溶液的质量的计算是初中化学计算的一个重点内容,其方法一般是:所加入的所有物质的质量总和-生成气体的质量-生成沉淀的质量.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 111 44
x y 2.2g
 ,x=5g
,x=5g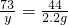 ,y=3.65g
,y=3.65g 该石灰石样品中碳酸钙的质量分数=
 ×100%=50%
×100%=50%(2)参加反应的盐酸的质量为=
 ×100%=10%
×100%=10%(3)36.5g+10gg-2.2g-(10g-5g)=39.3g
答:(1)石灰石样品中碳酸钙的质量分数为50%;(2)所用稀盐酸的溶质质量分数为10%
(3)所得溶液的质量为39.3g
分析:(1)根据二氧化碳的质量可求出碳酸钙的质量,最后根据
 ×100%可求出石灰石样品中碳酸钙的质量分数.
×100%可求出石灰石样品中碳酸钙的质量分数.(2)根据二氧化碳的质量可求出盐酸的质量,再求所用稀盐酸的溶质质量分数;
(3)据图可看出石灰石样品恰好完全反应时所加稀盐酸的质量为36.5g,所得溶液的质量=所加入的所有物质的质量总和-生成气体的质量-沉淀的质量.
点评:求反应后所得溶液的质量的计算是初中化学计算的一个重点内容,其方法一般是:所加入的所有物质的质量总和-生成气体的质量-生成沉淀的质量.

练习册系列答案
相关题目
某学校的研究性学习小组在实践活动中了解到,某石材厂有一批石灰石原料,其所含的杂质既不溶于水,也不溶于盐酸.为了测定该石灰石的纯度,该研究性学习小组取用4g这种石灰石样品,用实验室现有稀盐酸40g分4次加入.每次充分反应后,经过滤、干燥等操作.操作后称量固体物质的质量.每次稀盐酸的用量及剩余固体的质量见下表.(假设过滤、干燥等操作过程,固体物质不受损耗)
计算:
(1)该石灰石样品的纯度是多少?
(2)第三次产生的二氧化碳的质量是多少?
| 稀盐酸的用量 | 剩余固体的质量 |
| 第一次加入10g | 3.0g |
| 第二次加入10g | 2.0g |
| 第三次加入10g | 1.0g |
| 第四次加入10g | 0.4g |
(1)该石灰石样品的纯度是多少?
(2)第三次产生的二氧化碳的质量是多少?
 现有10g石灰石样品与稀盐酸反应制取二氧化碳气体,反应产生的二氧化碳气体的质量与加入的稀盐酸的质量关系如图所示(提示:石灰石样品中的杂质不溶于水,也不发生反应).
现有10g石灰石样品与稀盐酸反应制取二氧化碳气体,反应产生的二氧化碳气体的质量与加入的稀盐酸的质量关系如图所示(提示:石灰石样品中的杂质不溶于水,也不发生反应). 某化学兴趣小组为了测定当地石灰石的纯度(查资料已知,石灰石中含有二氧化硅,二氧化硅不溶于水,不能与盐酸反应,高温时不发生分解反应).现取用8g该石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸40g分4次加入,充分反应后,经过滤、干燥等操作后称量,每次稀盐酸用量及剩余固体的质量见下表,利用实验数据绘制的图象见下图.
某化学兴趣小组为了测定当地石灰石的纯度(查资料已知,石灰石中含有二氧化硅,二氧化硅不溶于水,不能与盐酸反应,高温时不发生分解反应).现取用8g该石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸40g分4次加入,充分反应后,经过滤、干燥等操作后称量,每次稀盐酸用量及剩余固体的质量见下表,利用实验数据绘制的图象见下图.