题目内容
某石灰厂需要测定产品生石灰中杂质(杂质只含CaCO3)的质量分数.小刚进行了如图实验.请计算: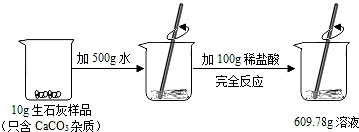
(1)生成CO2气体的质量;
(2)样品中CaCO3的质量分数.
【考点】根据化学反应方程式的计算.
【专题】压轴实验题;综合计算(图像型、表格型、情景型计算题).
【分析】根据反应前后的质量差可以求出生成二氧化碳的质量,根据二氧化碳的质量可以求出碳酸钙的质量.
【解答】解:(1)反应前后的质量差即是生成的二氧化碳的质量,生成的二氧化碳的质量为:10g+500g+100g﹣609.78g=0.22g,
答:生成CO2气体的质量为0.22g.
(2)解:设样品中CaCO3的质量为X,
CaCO3+2H Cl═CaCl2+H2O+CO2↑
Cl═CaCl2+H2O+CO2↑
100 44
X 0.22g
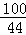 =
=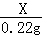
X=0.5g,
样品中CaCO3的质量分数为: ×100%=5%.
×100%=5%.
答:样品中CaCO3的质量分数为5%.
【点评】解答本题关键是要能够通过反应前后的质量差,求出生成的二氧化碳的质量,其它计算就迎刃而解了.

 备战中考寒假系列答案
备战中考寒假系列答案某同学拟探究物质燃烧的条件,请协助完成下列表格.
| 实验步骤 | 实验装置图 | 实验现象 | 结论 |
| 实验①用棉花分别蘸取酒精和水,放到酒精灯火焰上加热片刻.(图1所示). |
| 酒精燃烧,水没有燃烧 | 燃烧需要的条件之一是 |
| 实验②从乒乓球和滤纸上分别剪下同样大小的一小片,分别放在放在薄铜片的中部(图2所示). |
| 乒乓球片先燃烧,滤纸片后燃烧 | 燃烧需要的条件之一是 |
| 实验③(1)将白磷放入8℃0热水中(图3所示). (2)将白磷放入80℃0热水中并通入氧气(图4所示). |
| 图3中的白磷 图4中的白磷 | 物质燃烧需要氧气 |
问题讨论:
(1)白磷燃烧的化学方程式是 .
(2)进行实验①时,如果在酒精灯上加热时间较长,蘸水的棉花球也会燃烧起来,其原因是 .
(3)实验②中利用了铜片 .
(4)实验③中做两次实验的目的是 .
下列有关“物质——性质——用途”的叙述中,用途与性质不相关的是
| 序号 | 物质 | 性质 | 用途 |
| A | 一氧化碳 | 还原性 | 冶炼金属 |
| B | 氧气 | 助燃性 | 医疗急救 |
| C | 氮气 | 稳定性 | 食品防腐 |
| D | 干冰 | 升华时吸收热量 | 制冷剂 |