题目内容
16.现有18.6g NaOH、Na2CO3固体,在室温下,将该混合物与100g稀硫酸混合,恰好完全反应,所得不饱和溶液质量114.2g,则原固体中含有钠元素的质量为( )| A. | 3.3 g | B. | 4.6 g | C. | 9.2 g | D. | 13.8 g |
分析 根据质量守恒定律可以计算出二氧化碳的质量,进而求出碳酸钠的质量和氢氧化钠的质量,进一步求出钠元素的质量.
解答 解:生成二氧化碳的质量为:18.6g+100g-114.2g=4.4g,
设碳酸钠的质量为x,
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
x 4.4g
$\frac{106}{x}=\frac{44}{4.4g}$
x=10.6g
氢氧化钠的质量为18.6g-10.6g=8g,
则原固体中含有钠元素的质量为10.6g×$\frac{46}{106}×100%$+8g×$\frac{23}{40}×100%$=9.2g
答案:C.
点评 此题是一道综合性化学计算题,解题的关键是质量守恒定律的巧妙使用,此题难度较大,是一道综合性较强的计算题.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
6. 甲、乙两种固体物质的溶解度曲线如图所示,下列说法正确的是( )
甲、乙两种固体物质的溶解度曲线如图所示,下列说法正确的是( )
 甲、乙两种固体物质的溶解度曲线如图所示,下列说法正确的是( )
甲、乙两种固体物质的溶解度曲线如图所示,下列说法正确的是( )| A. | 20℃时,甲、乙物质的溶解度都等于40 | |
| B. | 升温可使乙物质的饱和溶液析出固体 | |
| C. | 甲、乙物质的溶解度都随着温度的升高而变大 | |
| D. | 40℃时,将甲、乙两物质饱和溶液分别降温到20℃,二者的溶质质量分数相等 |
4.下列变化中,属于化学变化的是( )
| A. | 纸张燃烧 | B. | 水结成冰 | C. | 干冰升华 | D. | 海水晒盐 |
11.氧化汞受热时的变化可用如图表示( 表示汞原子,
表示汞原子, 表示氧原子).据图得出的下列结论不正
表示氧原子).据图得出的下列结论不正
确的是( )

 表示汞原子,
表示汞原子, 表示氧原子).据图得出的下列结论不正
表示氧原子).据图得出的下列结论不正确的是( )

| A. | 氧化汞受热时能分解成汞和氧气 | B. | 原子是化学变化中的最小的微粒 | ||
| C. | 分子在化学变化中可以再分 | D. | 所有的物质都是由分子构成的 |
1.相关实验原理与化学方程式的书写都正确的是( )
| A. | 工业制取二氧化碳:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | |
| B. | 洗去试管壁上附着的铜:Cu+H2SO4═CuSO4+H2↑ | |
| C. | 用氢氧化钠吸收二氧化硫:2NaOH+SO2═Na2SO4+H2O | |
| D. | 铁丝在氧气中燃烧:4Fe+3O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3 |
5.下列各组物质的溶液不用其他试剂无法鉴别的是( )
| A. | H2SO4NaClNa2CO3CaCl2 | B. | HCl NaOHCuSO4 MgSO4 | ||
| C. | NaNO3HCl CaCl2KOH | D. | Na2CO3 K2SO4 BaCl2HCl |
6.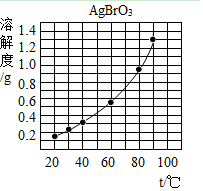 溴酸银(AgBrO3)的溶解度随温度变化曲线如图所示,下列说法不正确的是( )
溴酸银(AgBrO3)的溶解度随温度变化曲线如图所示,下列说法不正确的是( )
 溴酸银(AgBrO3)的溶解度随温度变化曲线如图所示,下列说法不正确的是( )
溴酸银(AgBrO3)的溶解度随温度变化曲线如图所示,下列说法不正确的是( )| A. | 升高温度溴酸银的溶解度增大 | |
| B. | 40℃时溴酸银易溶于水 | |
| C. | 90℃时溴酸银溶液的溶质质量分数一定小于1.3% | |
| D. | 溴酸银可用降温结晶的方法从溶液中析出 |
